
| A. | 气体物质加压或降温时能凝结或凝固 | |
| B. | 碘溶于四氯化碳 | |
| C. | 氟、氯、溴、碘单质的熔沸点依次升高 | |
| D. | 食盐熔化 |
分析 A.分子晶体的三态变化与范德华力有关;
B.碘单质分子间存在范德华力;
C.卤素单质的相对分子质量越大,范德华力越大,熔沸点越高;
D.食盐属于离子晶体.
解答 解:A.分子晶体中存在范德华力,则分子晶体的三态变化与范德华力有关,故A不选;
B.碘单质分子间存在范德华力,所以碘溶于四氯化碳破坏范德华力,故B不选;
C.卤素单质的相对分子质量越大,范德华力越大,熔沸点越高,则氟、氯、溴、碘单质的熔沸点依次升高,故C不选;
D.食盐属于离子晶体,熔化时破坏离子键,与范德华力无关,故D选.
故选D.
点评 本题考查了范德华力、离子键,题目难度不大,注意把握范德华力属于分子间作用力以及对物质性质的影响.


科目:高中化学 来源: 题型:选择题
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 | |
| B. | NH3为三角锥形,甲烷是正四面体形 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较弱 | |
| D. | NH3和CH4都是sp3型杂化,键角都是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
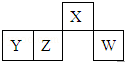 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | X的氢化物与氯化氢反应的产物溶于水形成的溶液呈酸性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | 含Y元素的盐溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气极易溶于水,所得的氨水中存在3种不同的氢键 | |
| B. | [Ag(NH3)2]+ 中含有6个σ键 | |
| C. | [Ag(NH3)2]OH所含有的化学键有离子键、极性共价键和配位键 | |
| D. | 在[Ag(NH3)2]+离子中Ag+给出孤对电子,NH3提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子序数是15 | B. | 它是非金属元素 | ||
| C. | 磷原子最外层有5个电子 | D. | 磷元素在地壳中的含量为30.97% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3分子中的3个碳原子不可能在同一直线上 | |
| B. | 油脂在酸性条件下的水解反应称为皂化反应 | |
| C. | 聚氯乙烯、麦芽糖和蛋白质均属于有机高分子化合物 | |
| D. | CH3CH2OH与CH3CO18OH发生酯化反应所得混合液中,18O原子只存在于水分子中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com