
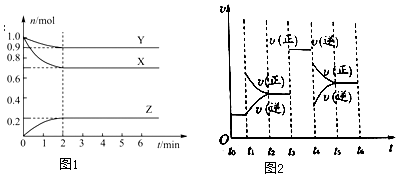
���� ��1���������ʵ����仯���ߣ���֪X��Y���ʵ�����С��Ϊ��Ӧ���Ӧ��û����ȫ��Ӧ�����Ը÷�ӦΪ���淴Ӧ��Z���ʵ������ӣ�Ϊ������ٸ��������ʵ����仯��֮�ȵ����������֮�ȣ���д����ѧ����ʽ��
��2������2min��Z���ʵ����仯���������������֪��Ũ�ȱ仯����ͨ�������֪������Z��ʾ�ķ�Ӧ���ʣ�
��3���������ѹǿ֮�ȵ�����������ʵ���֮�ȣ��������ʼʱ����������ʵ�����ƽ������������ʵ������õ��𰸣�
�������С��ԭ����0.5������ѹǿ��Ϊԭ����2����ƽ���������������С�ķ����ƶ������ݷ�Ӧ����ʽ��֪��ƽ�������ƶ���
��4����������Ӧ��2min���t1��t6�ڷ�Ӧ�����뷴Ӧʱ��Ĺ�ϵ��Ӱ�췴Ӧ��������������Ũ�ȡ�ѹǿ���������¶ȵȣ�
��ͼ�������֪t3��t4 ƽ�ⲻ����t4��t5 ƽ��������У�
��� �⣺��1����ͼ���֪X��YΪ��Ӧ�ZΪ�����X��Y��Z�Ļ�ѧ������֮�ȵ������ǵ����ʵ����仯֮��Ϊ0.3��0.1��0.2=3��1��2�����Է���ʽΪ3X+2Y?2Z���ʴ�Ϊ��3X+2Y?2Z��
��2��v��Z��=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05 mol•L-1•min-1���ʴ�Ϊ��0.05 mol•L-1•min-1��
��3���ٸ���ͼ���п�֪����ʼʱ���������ʵ���Ϊ��2mol��ƽ������������ʵ���Ϊ��0.9mol+0.7mol+0.2mol=1.8mol��$\frac{{P}_{ƽ��}}{{P}_{��ʼ}}$=$\frac{{n}_{ƽ��}}{{n}_{��ʼ}}$=$\frac{1.8mol}{2mol}$�T0.9��
�ʴ�Ϊ��0.9��
�ڸ��ݷ���ʽ����С�����ƽ�������ƶ����������¶Ƚ����ߣ��ʸ÷�ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
��4���ٸ���ͼ��t1ʱ�������������Ũ�ȣ�ƽ�������ƶ���t3ʱ�����˴�����ƽ�ⲻ�ƶ���t4ʱ��Ӧ���ʼ�С��ƽ��������У���ӦΪ���ȷ�Ӧ���ı�������ǽ����¶ȣ�t1������Ӧ��Ũ�� t2���Ӵ��� t4�������¶�
�ʴ�Ϊ������Ӧ��Ũ�ȣ��Ӵ����������¶ȣ�
��ͼ�������֪t3��t4 ƽ�ⲻ����t4��t5 ƽ��������У�Z�����������ߵ���t5��t6����ѡD��
�ʴ�Ϊ��D��
���� ����ͨ��ͼ�������ʵ����ʵ����ı仯�������黯ѧƽ����ƶ�����ѧ��Ӧ���ʼ��㣬�ۺϿ���ѧ����֪ʶ���ۺ�Ӧ����������Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����
����
 ��
�� ��
��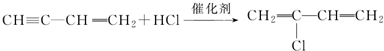 ��
��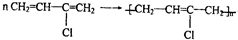 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��25mL�ζ������к͵ζ�ʱ����ȥijŨ�ȵ�NaOH��Һ21.70mL | |
| B�� | ��������ƽ����25.20gNaCl | |
| C�� | ��10mL��Ͳ��ȡ7.15mLϡ���� | |
| D�� | �ù㷺pH��ֽ���ij��Һ��pHΪ12.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
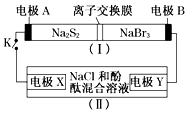 ��ͼ��ʾ��װ�ã�����һ�ֿɳ���ص�ʾ��ͼ��װ�ã���Ϊ���ص�ʾ��ͼ��װ�ã������ӽ���Ĥֻ����Na+ͨ������س䡢�ŵ�Ļ�ѧ����ʽΪ��2Na2S2+NaBr3$?_{���}^{�ŵ�}$Na2S4+3NaBr�����պ�Kʱ��X��������Һ�ȱ��ɫ������˵����ȷ���ǣ�������
��ͼ��ʾ��װ�ã�����һ�ֿɳ���ص�ʾ��ͼ��װ�ã���Ϊ���ص�ʾ��ͼ��װ�ã������ӽ���Ĥֻ����Na+ͨ������س䡢�ŵ�Ļ�ѧ����ʽΪ��2Na2S2+NaBr3$?_{���}^{�ŵ�}$Na2S4+3NaBr�����պ�Kʱ��X��������Һ�ȱ��ɫ������˵����ȷ���ǣ�������| A�� | װ�ã�����Na+������ͨ�����ӽ���Ĥ | |
| B�� | A�缫�ĵ缫��ӦʽΪNaBr3+2Na++2e-�T3NaBr | |
| C�� | X�缫�ĵ缫��ӦʽΪ2Cl--2e-�TCl2�� | |
| D�� | ÿ��0.1 mol Na+ͨ�����ӽ���Ĥ��X�缫�Ͼ�������״���µ�����1.12 L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������NaHCO3��μ���Ba��OH��2��Һ�У�HCO3-+Ba2++OH-�TBaCO3��+H2O | |
| B�� | NaHSO4��Һ��Ba��OH��2��Һ��Ӧ�����ԣ�H++SO42-+Ba2++OH-�TBaSO4��+H2O | |
| C�� | ��������Һ��ͨ��������CO2��2C6H5O-+CO2+H2O��CO32-+2C6H5OH | |
| D�� | ��100 mL 3mol•L-1FeBr2��Һ��ͨ���״���� 3.36 LCl2��2Fe2++4Br-+3Cl2�T2Fe3++2Br2+6Cl- |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com