
 2C(g)+2D(g),下列四个选项是不同情况下测得的该反应以不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是
2C(g)+2D(g),下列四个选项是不同情况下测得的该反应以不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是A.υ(A)=0.20 mol/(L·min)
B.υ(B)=0.45 mol/(L·s)
C.υ(C)=0.40 mol/(L·min)
D.υ(D)=0.35 mol/(L·min)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol?L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol?L-1)随反应时间(min)的变化情况如下表:| 时间 实验序号 |
1 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:



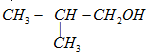
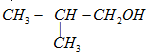






查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体.化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去.试回答下列问题:
如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体.化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去.试回答下列问题:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | -3,+5 | +2 |
| ||
| ||
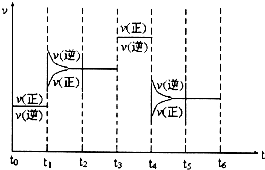
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com