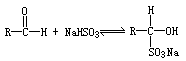这是一这典型的功能性信息给予实验题,①题给新信息是制取‘引火铁”的反应原理需同学们推理写出②“引火铁”的特性③两套未曾见过的新装置。解答中首先阅读题干“在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。”联想学过的反应:
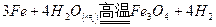
(普通铁粉)
由此反应推知制取“引火铁”的新反应为
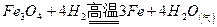
(引火铁)
即题中涉及铁的氧化物是Fe3O4(不是Fe2O3,也不是FeO),一定条件是指高温。
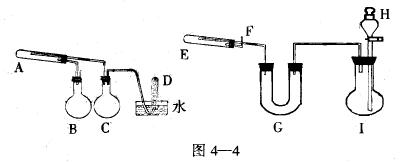
然后.仔细观察两套实验装置,可发现左边装置有用排水法收集反应生成气体(D试管)一定是H2,由此确认左边装置为制取铁的氧化物,而右边装置用于制取“引火铁”,这是本题解题的突破口,然后综合运用有关实验的知识和技能,结合对装置图的观察加工,即可解题如下:
(1)A中应加入普通铁粉,B是作为水蒸气发生器,因反应产生的H
2可能不连续,C瓶为防止水槽中的水倒吸而作缓冲瓶(较难),D中收集到的是H
2。
(2)右边的装置气流是从右到左,烧瓶I和分液漏斗H的组合一定是H
2发生装置,所用试剂自然是普通铁粉和6mol、L
-1盐酸,所以制得的H
2中含有HCl气体和H
2O(气),在制取“引火铁”之前必须净化、干燥,由此U形管G中应加入固体碱性干燥剂NaOH或碱石灰。
(3)根据题给两个反应的条件都是“高温”和要制取水蒸气的要求,可知实验时需要加热的仪器为A、B、E。
.(4)联想到课本习题(《化学选修第三册》P62第4题),在Zn和稀H
2SO
4反应制取H
2时加入少量CuSO
4溶液能使制取H
2的反应加快,可知,在I中加入少量CuSO4溶液,其目的是加快H
2的生成速度,原因是形成了无数微小的Fe-Cu原电池,加快了反应(析氢腐蚀)的进行。
(5)试管E中的反应自然是制取“引火铁”的反应。其关键在于反应物是Fe
3O
4而不是铁的其它氧化物。
(6)结合初中H
2还原CuO的实验可知,H
2在加热或点燃前一定要先验纯,所不同的是,本实验还要尽可能避免空气进入试管E,使制取的高活性的“引火铁”受热燃烧、所以要加带导管F的橡皮塞。此外E管反应后,为了防止F出口处的水蒸气凝结,堵塞出气口或回流到试管E将其炸裂,因此E管反应后,F出口处应点燃H
2。
本题以化学实报实销验为依托全面考查了观察、实验、思维、自学等诸多能力。其特点是:①题给新信息尽管很隐蔽,但仍源于课本;所给装置是由常用仪器装置重新组合而成的新颖、非常规装置。②设计仪器装置、选用药品时都打破常规,体现创新精神。如用烧瓶C作安全瓶;制取“引火铁”的装置顺序不是一般的从左→右,而是从右→左;气体的干燥、净化不用洗气装置也不用干燥管,而用U形管G代替;E试管的F出口不向下而是向上,引出剩余纯净的不污染空气的H
2要点燃处理等。
由此可见,直接观察事物的表象,这仅仅是认识的第一个环节,观察之后,还必须经过思考进行初步加工。所谓初步加工,就是将从观察中得到的印象初步加以分析,从中提取事物的特征;或者在对事物的观察中,归纳出同类事物共有的特性;还包括对所获信息进行分类,归纳出表象的规律,从而作出正确的判断。凡此种种,构成了观察能力。


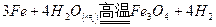
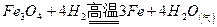 (引火铁)
(引火铁)