
 某无色稀溶液X中,可能含有如表所列离子中的某几种.
某无色稀溶液X中,可能含有如表所列离子中的某几种.| 阴离子 | CO${\;}_{3}^{2-}$、SiO${\;}_{3}^{2-}$、AlO${\;}_{3}^{-}$、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH${\;}_{4}^{+}$、Na+ |
| A. | 若Y是盐酸,则X中一定含有CO${\;}_{3}^{2-}$、SiO${\;}_{3}^{2-}$、AlO${\;}_{2}^{-}$和NH${\;}_{4}^{+}$ | |
| B. | 若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH${\;}_{4}^{+}$、Cl- | |
| C. | 若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH${\;}_{4}^{+}$+OH-=NH3↑+H2O | |
| D. | 若Y是NaOH溶液,则X中的Al3+、Mg2+、NH${\;}_{4}^{+}$物质的量之比为2:1:4 |
分析 溶液无色说明溶液中不含Fe3+;
(1)如果Y是盐酸,向溶液中加盐酸,先生成沉淀,则溶液中可能含SiO32-、AlO2-或两者中的一种,即生成的沉淀为H2SiO3、Al(OH)3或两者中的一种,则溶液中不含Al3+、Mg2+;当a-b段时,沉淀的量不变化,发生的是盐酸和碳酸根离子反应生成气体;当b-c段时沉淀的质量减少,即部分沉淀和盐酸反应,部分沉淀和盐酸不反应,说明生成的沉淀既有H2SiO3又有Al(OH)3,原溶液中有硅酸根离子和偏铝酸根离子,弱酸根离子和铵根离子能双水解,所以溶液中不含NH4+,含有的阳离子是Na+;
(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,当a-b段时,沉淀的量不变化,氢氧化钠和铵根离子反应生成气体;当b-c段时沉淀的质量减少,部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有铝根离子和镁离子,则溶液中不含硅酸根离子、碳酸根离子和偏铝酸根离子,所以溶液中含有的阴离子是氯离子.
解答 解:溶液无色说明溶液中不含Fe3+;
(1)如果Y是盐酸,向溶液中加盐酸,先生成沉淀,则溶液中可能含SiO32-、AlO2-或两者中的一种,即生成的沉淀为H2SiO3、Al(OH)3或两者中的一种,则溶液中不含Al3+、Mg2+;当a-b段时,沉淀的量不变化,发生的是盐酸和碳酸根离子反应生成气体:CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑;当b-c段时沉淀的质量减少,即部分沉淀和盐酸反应:Al(OH)3+3H+═Al3++3H2O,部分沉淀和盐酸不反应,说明生成的沉淀既有H2SiO3又有Al(OH)3,原溶液中有SiO32-和AlO2-,则oa段发生反应的离子方程式SiO32-+2H+═H2SiO3↓,AlO2-+H++H2O═Al(OH)3↓,由于SiO32-和AlO2-和铵根离子能双水解,所以溶液中不含NH4+,含有的阳离子是Na+.
则X中一定含有的离子是CO32-、SiO32-、AlO2-、Na+,oa段发生反应的离子方程式SiO32-+2H+═H2SiO3↓,AlO2-+H++H2O═Al(OH)3↓,ab段发生反应的离子方程式CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,bc段发生反应的离子方程式:Al(OH)3+3H+═Al3++3H2O.
综上可知含有的离子为:CO32-、SiO32-、AlO2-、Na+;
(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,溶液中可能含Al3+、Mg2+或两者中的一种,由于弱碱阳离子和弱酸根会双水解而不能共存,即溶液中不含CO32-、SiO32-、AlO2-,由于溶液一定要保持电中性,故溶液中一定含Cl-;当a-b段时,沉淀的量不变化,是氢氧化钠和铵根离子反应生成气体:NH4++OH-═NH3•H2O,即溶液中含NH4+;当b-c段时沉淀的质量减少但没有完全溶解,即部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有Al3+、Mg2+,即bc段的反应为:Al(OH)3+OH-═AlO2-+2H2O.
综上可知,X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-;
A.由分析可知,若Y是盐酸,则X中一定含有:CO32-、SiO32-、AlO2-、Na+,故A错误;
B.若Y是氢氧化钠,X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-,没有Fe3+,故B错误;
C.若Y是NaOH溶液,当a-b段时,沉淀的量不变化,是氢氧化钠和铵根离子反应生成气体:NH4++OH-═NH3•H2O,故C错误;
D.与铵根离子反应需要氢氧化钠的体积是2v,氢氧化铝和氢氧化钠反应需要氢氧化钠的体积是1v,则生成氢氧化铝需要氢氧化钠的体积是3V,生成氢氧化镁需要氢氧化钠的体积是1V,则n(Al3+):n(Mg2+):n(NH4+)=1:$\frac{1}{2}$:2=2:1:4,故D正确.
故选D.
点评 本题考查离子检验及离子反应,根据溶液的颜色结合题给图象确定溶液中存在的离子,再结合物质之间的反应来确定微粒的量,同时考查学生思维的缜密性、考虑问题的全面性,题目较难.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入FeCl3溶液显紫色,说明存在酚羟基 | |
| B. | 加入金属钠能放出氢气,说明存在羧基 | |
| C. | 能使酸性高锰酸钾溶液褪色,说明存在碳碳双键 | |
| D. | 在2mL 2%的CuSO4溶液中加入10%的NaOH溶液4~5滴配制成氢氧化铜悬浊液,用以检验醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.05 NA个CO2分子所占的体积是1.12 L | |
| B. | 把200 mL 1.5 mol•L-1的BaCl2溶液跟100 mL 3 mol•L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol•L-1(忽略混合后溶液体积的变化) | |
| C. | 常温常压下,32 g氧气和32 g H2S分子个数比为1:1 | |
| D. | 标准状况下,NA个水分子所占的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
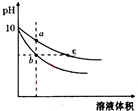 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | 稀释之前,两溶液导电能力相同 | |
| C. | a、b、c三点溶液中水的电离程度c>a>b | |
| D. | 用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vc>Vb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对盛在烧杯(敞口)内的氨水加热,氨水中NH${\;}_{4}^{+}$浓度减小 | |
| B. | 对石灰的悬浊液加热使温度升高,悬浊液中Ca(OH)2固体的含量增加 | |
| C. | 高压有利于合成氨的反应 | |
| D. | 500℃左右比室温更有利于合成氨的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com