
【题目】3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

反应结束后,先分离出甲醇,再加人乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然
后分离提纯得到产物。甲醇和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
甲醇 | 64.7 | -97.8 | 易溶于水 |
3,5-二甲氧基苯酚 | 172-175 | 33-36 | 易溶于甲醇、乙醚,微溶于水 |
下列说法正确的是
A. 分离出甲醇的操作是结晶
B. 间苯三酚与苯酚互为同系物
C. 上述合成反应属于取代反应
D. 洗涤时可以用饱和Na2CO3溶液除氯化氢
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,某研究小组用下图所示的实验装置,利用氢氧化钠固体、浓氨水、干冰等作原料制备氨基甲酸铵。主要反应原理:2NH3(g) + CO2(g)=H2NCOONH4(s) ΔH<0。

(1)仪器2的名称是_____________。仪器3中NaOH固体的作用是_____________。
(2)仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内稀硫酸溶液中产生气泡,应该_____________(填“加快”、“减慢”或“不改变”)产生氨气的流速。
(3)另有一种制备氨基甲酸铵的反应器(CCl4充当惰性介质)如下图:

①若无冰水,则氨基甲酸铵易分解生成尿素[化学式为CO(NH2)2]。请写出氨基甲酸铵受热分解的化学反应方程式:_____________。
②当CCl4液体中产生较多晶体悬浮物时,即停止反 应,过滤分离得到粗产品,为了将所得粗产品干燥可采取的方法是_____________。
A.蒸馏 B.高压加热烘干 C.真空微热烘干
(4)已知氨基甲酸铵可完全水解为碳酸氢铵,则该反应的化学方程式为_____________。
为测定某样品中氨基甲酸铵的质量分数,某研究小组用该样品进行实验。已知杂质不参与反应,请补充完整测定某样品中氨基甲酸铵质量分数的实验方案:用天平称取一定质量的样品,加水溶解,_____________,测量的数据取平均值进行计算(限选试剂:蒸馏水、澄清石灰水、BaCl2溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿制备铝所涉及的下列有关反应中,属于氧化还原反应的是 ( )
A.铝土矿溶于NaOH溶液中 B.偏铝酸钠溶液的酸化
C.灼烧氢氧化铝固体 D.电解熔融的氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计的用化学电源使LED灯发光的装置如图。下列说法错误的是( )
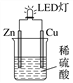
A. 铜片表面有气泡生成,锌片上发生氧化反应
B. 如果将稀硫酸换成葡萄糖溶液,不能使LED灯发光
C. 装置中存在“化学能→电能→光能”的转换
D. 如果将铜片换成铁片,则锌片为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠。从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应。下列对此实验的说法中,不正确的是()

A. 所充氯气应用向上排空气法收集
B. 反应中,烧瓶内产生大量白色烟雾
C. 玻璃导管只起到定位加入钠和水的作用
D. 烧瓶中Cl2,可能参与四个氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,需加入还原剂才能实现的变化是
A. HCO3-→ CO32- B. MnO2→ Mn2+
C. I-→ I2 D. FeO → Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_________种。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子轨道表示式为________________。乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。1mol (C2H5O)3P=O分子中含有的σ键与π键的数目比为_________。
已知固态NH3、H2O、HF的氢键键能和结构如下:


①在冰晶体中每个水分子被距离最近的_____个水分子包围形成_____________构型。
②解释H2O、HF、NH3沸点依次降低的原因___________________。
(5)碳化硅的结构与金刚石类似(如图所示),其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有___________个,与碳原子等距离最近的碳原子有__________个。已知碳原子的半径为a nm,硅原子的半径为b nm,则碳化硅的密度为__________g·cm-3 (只需列出计算式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com