
【题目】某化学兴趣小组选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。
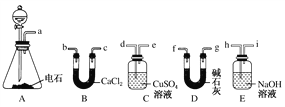
(1)A中制取乙炔的化学方程式为_________________________________。
(2)制乙炔时,旋开分液漏斗的活塞,使水慢慢滴下的原因是_________________。
(3)用电石制得的乙炔中常含有H2S、PH3等杂质,除去杂质应选用________(填序号,下同)装置,干燥乙炔最好选用________装置。
(4)为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:
纯净乙炔气![]() 混合液
混合液![]() 有机混合物Ⅰ
有机混合物Ⅰ![]() 混合液
混合液![]() 有机混合物Ⅱ
有机混合物Ⅱ
①操作b的名称是________;
②有机混合物Ⅰ可能含有的物质是________(写结构简式)。
【答案】 CaC2+2H2O→C2H2↑+Ca(OH)2 控制反应速率,使产生的气流稳定,避免产生的泡沫进入导管 C D 蒸馏(或分馏) CH2===CHBr、CH3—CHBr2、CH2Br—CH2Br
【解析】试题分析:本题考查乙炔的实验室制备,乙炔性质的实验探究。
(1)电石和水反应制乙炔,制取乙炔的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑。
(2)由于电石与水反应剧烈,产生乙炔的速率很快,所以制乙炔时旋开分液漏斗的活塞使水慢慢滴下的目的是:控制反应速率,使产生的气流稳定,避免产生的泡沫进入导管。
(3)用电石制得的乙炔中常含有H2S、PH3等杂质,选用CuSO4溶液除去H2S、PH3,反应的化学方程式为:CuSO4+H2S=CuS↓+H2SO4、PH3+4CuSO4+4H2O=H3PO4+4H2SO4+4Cu,应选用装置C。由于碱石灰的干燥能力强于氯化钙,干燥乙炔最好选用碱石灰,应选用装置D。
(4)乙炔与HBr若1:1加成生成CH2=CHBr,若1:2加成生成CH3CHBr2或CH2BrCH2Br,这些产物都属于溴代烃,它们在NaOH水溶液、加热条件下发生水解,CH2=CHBr、CH3CHBr2水解生成的CH2=CHOH、CH3CH(OH)2都不稳定,会自动转化成CH3CHO,CH2BrCH2Br水解生成HOCH2CH2OH。
①水解后的有机混合液为互相混溶的液态混合物,进行分离的操作b为蒸馏(或分馏)。
②有机混合物I是乙炔与HBr的加成产物,其可能含有的物质是:CH2=CHBr、CH3CHBr2、CH2BrCH2Br。


科目:高中化学 来源: 题型:
【题目】将镁、铝的混合物共0.2mol,溶于200mL 4molL﹣1的盐酸溶液中,然后再滴加2molL﹣1的NaOH溶液.请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m 随加入NaOH溶液的体积V变化情况如图所示.当V1=160mL时,则金属粉末中n (Al)=mol 
(2)0~V1段发生的反应的离子方程式为;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=mL;
(4)若镁、铝的混合物仍为0.2mol,其中镁粉的物质的量分数为a,改用200mL 4molL﹣1的硫酸溶解此混合物后,再加入840mL 2molL﹣1的NaOH溶液,所得沉淀中无Al(OH)3 , 则a的取值范围为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用烧热的钢针去接触涂有薄薄一层石蜡的云母片的反面,熔化了的石蜡呈椭圆形,这是因为( )。
A.云母是热的不良导体,传热不均匀
B.石蜡是热的不良导体,传热不均匀
C.石蜡具有各向异性,不同方向导热性能不同
D.云母具有各向异性,不同方向导热性能不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子表、电子计算器、电脑显示器都运用了液晶材料显示图像和文字。有关其显示原理的叙述正确的是( )
A.施加电压时,液晶分子垂直于电场方向排列
B.移去电场后,液晶分子恢复到原来状态
C.施加电压时,液晶分子沿电场方向排列
D.移去电场后,液晶分子垂直于原电场方向排列
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知15P、33As位于同一主族.下列关系正确的是( )
A. 原子半径:As>Cl>P B. 非金属性:Cl>S>As
C. 热稳定性:HCl>AsH3>PH3 D. 酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2)在工业上具有非常广泛的应用。某化学兴趣小组用镁与氮气反应制备Mg3N2并进行有关实验。实验装置如下所示:
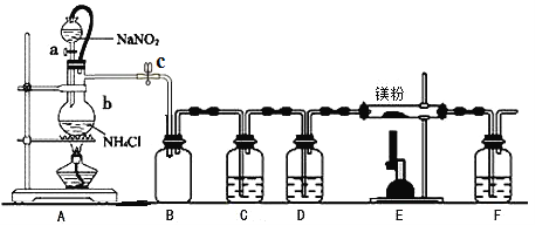
已知:①氮化镁常温下为浅黄色粉末,极易与水反应。
②亚硝酸钠和氯化铵制取氮气的反应剧烈放热,产生氮气的速度较快。
③温度较高时,亚硝酸钠会分解产生O2等。
回答下列问题:
(1)仪器b的名称是________,写出装置A中发生反应的化学方程式___________________。
(2)某同学检验装置A部分的气密性,关闭止水夹c后,开启活塞a,水不断往下滴,直至全部流入烧瓶。试判断:A部分装置是否漏气?________(填“漏气”、“不漏气”或“无法确定”),判断理由:____________。
(3)装置C中为饱和硫酸亚铁溶液,作用是___________,F装置的作用是_______________________。
(4)加热至反应开始发生,需移走A处酒精灯,原因是_______________________________________。
(5)反应结束后,取m g E中样品于试管中,加足量蒸馏水,得V mL气体(换算为标准状况),则样品中氮化镁的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等,回答下列问题:
(1)铅与碳是同族元素,则下列说法正确的是 .
a.主要化合价为+2,+4
b.同族的Si与Ge(锗)均为半导体材料,铅也为半导体材料.
c.铅的最高价氧化物对应水化物的酸性强于碳酸
d.与同族的Ge(锗)作比较:碱性Ge(OH)4<Pb(OH)4 , 则金属性Ge<Pb,周期表中位置Pb在Ge下面.
e.同族的Ge(锗)与盐酸不反应,Pb与盐酸能反应,则原子半径Ge>Pb
(2)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 .
(3)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g)△H=a kJmol﹣1
PbS(s)+2PbO(s)=3Pb(s)+SO2(g)△H=b kJmol﹣1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g)△H=c kJmol﹣1
反应3PbS(s)+6O2(g)=3PbSO4(s)△H=kJmol﹣1(用含a,b,c的代数式表示).
(4)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图1所示,该电池正极的电极反应式为 . 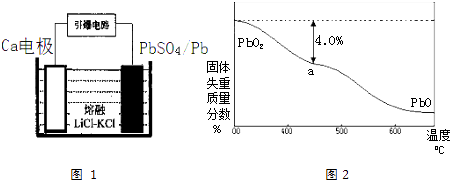
(5)PbO2在加热过程发生分解的失重曲线如图2所示,已知失重曲线上的a点为样品失重4.0%[即:( ![]() ×100%]的残留固体.若a点固体组成表示为PbOx或mPbO2nPbO,列式计算x值 , 和m:n值 .
×100%]的残留固体.若a点固体组成表示为PbOx或mPbO2nPbO,列式计算x值 , 和m:n值 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,表中的每个编号表示一种元素,请根据要求回答问题。
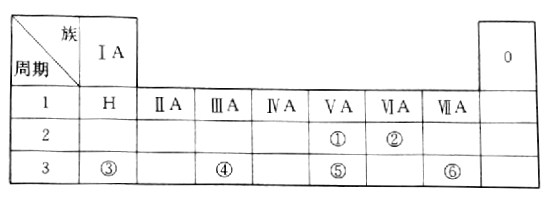
(1)② 表示的元素是______(填元素符号);
(2)①、⑤两种元素的原子半径大小为①______⑤(填“< ”或“>”);
(3)③、④两种元素的金属性强弱顺序为:③______④(填“< ”或“>”);
(4)写出③与⑥两种元素所形成化合物的化学式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com