
【题目】火箭使用偏二甲肼作燃料,四氧化二氮作氧化剂。引燃后产生的高温气体主要有CO2、H2O、NO、N2,但在卫星发射现场却看到火箭尾部喷出大量红烟,产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.CO2和NO反应生成NO2和CO
C.NO遇空气生成NO2
D.H2O和NO反应生成H2和NO2
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】下列对物质性质的描述中属于离子晶体的是( )
A.熔点是1070℃,易溶于水,水溶液能导电
B.熔点是10.31℃,液态不导电,水溶液能导电
C.熔点3550℃,硬度大,不导电
D.熔点是97.80℃,质软、导电,密度是0.97g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,下列说法不正确的是

A. 利用图甲装置,可以防止铁钉生锈
B. 利用图乙装置,可以用乙醇和浓硫酸制备乙烯
C. 利用图丙装置,可以加热NH4Cl固体制NH3
D. 利用图丁装置,可以研究Ca(OH)2的溶解度随温度的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2 .
(1)A分子的质谱图如图所示,从图中可知其相对分子质量是90,则A的分子式是 . 
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是 .
(3)A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是 .
(4)0.1mol A与足量Na反应,在标准状况下产生H2的体积是L.
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚戊二酸丙二醇(PPG)是一种可降解的聚脂类高分子材料,在材料的生物相容性方面有限好的应用前景.PPG的一种合成路线如下: 
已知;
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢
②化合物B为单氯代烃;化合物C的分子式为C5H8
③E、F为相对分子质量差14的同系物,F是福尔马琳的溶质
④R1CHO+R2CH2CHO ![]()
![]()
回答下列问题:
(1)A的结构简式为 .
(2)由B生成C的化学方程式为 .
(3)由E和F生成G的反应类型为 , E的化学名称为 .
(4)由D和H生成PPG的化学方程式为;
(5)D的同分异构体能同时满足下列条件的共有种(不含立体异构); ①能与饱和NaHCO3溶液反应产生液体
②既能发生银镜反应,又能发生水解反应,其中核磁共振请谱显示为3组峰,且峰面积比为6:1:1的是有(写结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气脱硫能有效减少二氧化硫的排放。目前最常用的脱硫技术是湿法石灰石—石膏脱硫,即利用石灰石和烟气中的SO2反应生成石膏一脱除SO2。某研究性学习小组在实验室利用如图所示装置制备模拟烟气(主要成分为SO2、CO2、N2、O2),并测定烟气中SO2的体积分数以及研究烟气通过转化器的脱硫效率。回答下列问题:
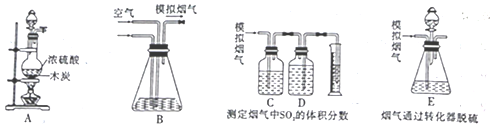
Ⅰ.模拟烟气的制备。
(1)装置 A中盛装浓硫酸的仪器名称是_____________,写出装置A中发生反应的化学方程式:________。
Ⅱ.测定烟气中SO2的体积分数。
(2)已知装置C、D中盛有的药品分别是酸性KMnO4溶液、饱和NaHCO3溶液,写出装置C的作
用:_______________,装置D中饱和NaHCO3溶液中的离子浓度由大到小的关系为_____________。
(3)①甲同学认为应该在装置C、D之间增加一个盛有品红溶液的洗气瓶,理由是_____________。
②乙同学根据模拟烟气的流速a mL/min和t1分钟后测得的量筒内液体的体积VmL,计算烟气中二氧化硫的体积分数。为保证准确读取量筒读数应注意:a.将装置冷却至室温;b._________;c.平视。
Ⅲ.模拟烟气通过转化器的脱硫效率研究。
(4)将模拟烟气通过装置E,其中盛有FeCl2、FeCl3的混合溶液,它可以催化SO2与氧气的反应以达到脱硫的目的。写出催化剂参与反应过程中的离子方程式:SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+、____________。
(5)若模拟烟气仍以amL/min的流速通过转化器E装置,t2分钟后,向E装置中加入酸化的BaCl2溶液,得到白色浑浊液,经过滤、洗涤、干燥、称量,得到m g固体。若实验测得的气体体积已折算为标准状况下的体积,则该转化器的脱硫效率是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废液主要成分为SiO2、FeO、Fe2O3、Al2O3 等,为综合利用,对其进行如下处理,制备Al2O3及(NH4)2Fe(SO4)2·6H2O。

相关数据如下:
Kb(NH3·H2O) | 1.8×10-5 | 溶解度/g | 10℃ | 30℃ | 50℃ |
Ksp[A1(OH)3] | 1.3×10-33 | (NH4)2SO4 | 73.0 | 78.0 | 84.5 |
Ksp[Fe(OH)2] | 8.0×10-16 | FeSO4·7H2O | 40.0 | 60.0 | |
Ksp[Fe(OH)3] | 4.0×10-38 | |(NH4)2Fe(SO4)2·6H2O | 18.1 | 24.5 | 31.3 |
(1)酸浸过程中产生的滤渣的主要成分是_______________。
(2)滤液①中加入铁粉的作用是__________________。
(3)已知加入氨水前,溶液中H+、Fe2+、Al3+的浓度分别为0.02 mol/L、0.16mol/L、0.04mol/L,加人氨水后,溶液的体积刚好增加1倍。为防止Fe2+ 产生沉淀,则溶液中的pH不能超过_______,此时溶液中n(NH3·H2O):n(NH4+)≤_____________;若调节溶液pH为5,则溶液中所有离子的物质的量浓度由大到小排列的顺序是_________________。
(4)由滤液②制备(NH4)2Fe(SO4)2·6H2O 晶体时,为防止有(NH4)2SO4或FeSO4晶体析出,须先向滤液②中加人适量的______________,再蒸发浓缩、__________、过滤、__________、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com