
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
分析 先根据反应生成白色沉淀判断该卤代烃为氯代烃,再结合Y的相对分子质量利用商余法确定其分子式;氯代烃发生消去反应生成烯烃,直接根据烯烃的同分异构体数目进行解答即可.
解答 解:最终得到白色沉淀,该白色沉淀为AgCl,则该卤代烃为氯代烃,生成的氯化银的物质的量为:$\frac{14.35g}{143.5g/mol}$=0.1mol,
Y中含有Cl原子数为:$\frac{0.1mol}{0.1mol}$=1,卤代烃Y的相对分子质量为92.5,则Y中C、H总原子量为:92.5-35.5=57,
利用商余法可得:$\frac{57}{14}$=4…1,则Y的分子式为:C4H9Cl,
Y在氢氧化钠的醇溶液中加热发生消去反应生成丁烯,丁烯的同分异构体有:CH3CH2CH=CH2、CH3CH=CHCH3、CH3C(CH3)=CH2,
所以Y与NaOH的乙醇溶液共热,反应后生成的不饱和烃有3种,
故选C.
点评 本题考查了有机物分子式的确定、同分异构体的书写,题目难度中等,根据题干信息正确推断Y的分子式为解答关键,注意掌握同分异构体的概念及书写原则.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验目的 | T/℃ | NO初始浓度mol/L | CO初始浓度mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 4.00×10-3 | 120 | ||
| Ⅲ | 探究温度对反应速率的影响 | 360 | 80 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol铁完全反应,一定失去2NA个电子 | |
| B. | 1mol任何物质都约含6.02×1023个分子 | |
| C. | 等物质的量的NO和NO2含的N原子数均为1mol | |
| D. | 标况下,22.4L氦气所含的原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的种类很多,但它们水解后都一定有一产物相同 | |
| B. | 淀粉、纤维素都属糖类,它们通式相同,但它们不互为同分异构体 | |
| C. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 | |
| D. | 只用新制的Cu(OH)2悬浊液可以鉴别乙酸溶液、葡萄糖溶液和淀粉溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
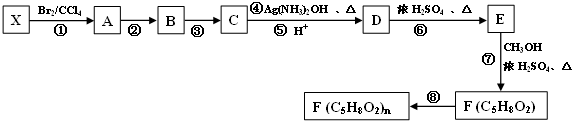
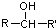 $\stackrel{[O]}{→}$
$\stackrel{[O]}{→}$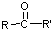 ,
,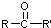 不易被氧化成羧酸
不易被氧化成羧酸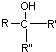 不易被氧化成醛或酮
不易被氧化成醛或酮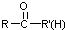 $\stackrel{HCN}{→}$
$\stackrel{HCN}{→}$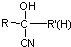 $\stackrel{H^{+}/H_{2}O}{→}$
$\stackrel{H^{+}/H_{2}O}{→}$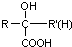 (R、R′、R″均代表烃基 )
(R、R′、R″均代表烃基 )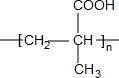 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 符合通式CnH2n+2的均属于烷烃 | B. | 丙烷分子中所有原子共平面 | ||
| C. | 丁烷的一氯代物有5种 | D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
“低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4和PCl3 | B. | NaCl和HCl | C. | CO2和SiO2 | D. | NaH和Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
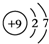 ,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号);
,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号); ,ED4的电子式是
,ED4的电子式是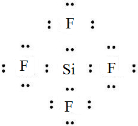 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com