
判断下列物质在下列变化过程中克服微粒之间的作用力类型:
(1)碘升华________.
(2)氯化钠晶体熔化________.
(3)硫化氢受热分解成硫和氢气________.
(4)电解水生成氢气和氧气________.
(5)水汽化生成水蒸气________.
(6)乙醇挥发________.
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
 氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: 2NH3(g)△H<0,得到如下数据:
2NH3(g)△H<0,得到如下数据:| 实验组 | 温度/℃ | 起始量/mol | 2分钟/mol | 平衡常数 | |
| H2 | N2 | NH3 | |||
| 1 | 298 | 6 | 2 | 1.2 | 4.1×106 |
| 2 | 398 | 3 | 1 | 0.8 | K1 |
| [c(NH3)]2 |
| c(N2)[c(H2)]3 |
| [c(NH3)]2 |
| c(N2)[c(H2)]3 |
 NH3?HDO+D+
NH3?HDO+D+ NH3?HDO+D+
NH3?HDO+D+查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化学 来源:江苏省扬州中学2012届高三3月双周练习(一)化学试题 题型:043
依据题目要求回答下列问题.
(1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合H+能力最强的是________.
②浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是________(填编号);将各溶液分别稀释100倍,pH变化最小的是________(填编号)
A.HCN
B.HClO
C.C6H5OH
D.CH3COOH
E.H2CO3
③据上表数据,请你判断下列反应不能成立的是________(填编号)
A.CH3COOH+Na2CO3![]() NaHCO3+CH3COONa
NaHCO3+CH3COONa
B.CH3COOH+NaCN![]() CH3COONa+HCN
CH3COONa+HCN
C.CO2+H2O+NaClO![]() NaHCO3+HClO
NaHCO3+HClO
D.CO2+H2O+2C6H5ONa![]() Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为________.
(2)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________.
(3)已知可逆反应FeO(s)+CO2(g)![]() Fe(s)+CO(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
①写出该反应平衡常数的表达式为________.
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度________(选填“增大”“减小”或“不变”);当![]() ,1 mol混合气体的质量为________g.
,1 mol混合气体的质量为________g.
查看答案和解析>>
科目:高中化学 来源:2012届湖北省黄冈市高三上学期期末考试理科综合_化学部分(解析版) 题型:填空题
(14分)依据题目要求回答下列问题。
(1)常温下,浓度均为0.lmol·L-1的下列六种溶液的pH如下表: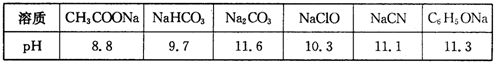
①上述盐溶液中的阴离子,结合H+能力最强的是
②根据表中数据,浓度均为0.0lmol·L-1的下列五种物质的溶液中,酸性最强的是 (填编号);将各溶液分别稀释100倍,pH变化最小的是 (填编号)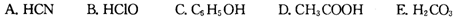
③据上表数据,请你判断下列反应不能成立的是 (填编号)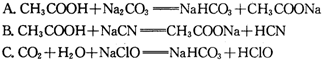

④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为 。
(2)已知常温下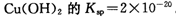 。又知常温下某CuSO4溶液里
。又知常温下某CuSO4溶液里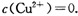
02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于____.
(3)已知可逆反应 是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
①写出该反应平衡常数的表达式:____ 。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度 (选填“增大”“减小”或“不变”);当 ,混合气体平均相对分子质量为 。
,混合气体平均相对分子质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
尿素[CO(NH2)2]是首个由无机物人工合成的有机物。工业上合成尿素的反应如下:
![]() 。回答下列问题:
。回答下列问题:
(1)已知工业上合成尿素分两步进行,相关反应如下:
![]()
下列示意图中[a表示2NH3(g)+CO2(g),b表示NH2COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号) 。

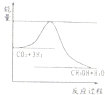
 (2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为 。
②为提高尿素的产率,下列可以采取的措施有 。
A.缩小反应容器的容积 B.升高温度
C.平衡体系中及时分离出CO(NH2)2 D.使用合适的催化剂
③该反应的平衡常数表达式K= ;若升高体系的温度,容器中NH3的体积分数将 (填“增加”、“减小”或“不变”)。
④若保持平衡的温度和压强不变,再向容器中充入3mol的氨气,则此时v正 v逆(填“>”“=”或“<”),判断理由 。
⑤若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com