
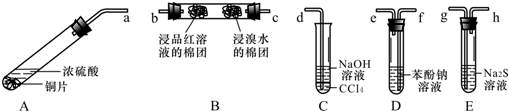
分析 由实验目的可知,A为制备二氧化硫的发生装置,发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,D装置利用强酸制备弱酸原理检验其酸性氧化物的性质,B中溴水具有强氧化性,可以检验二氧化硫的还原性,二氧化硫与品红化合为无色物质,可以检验二氧化硫的漂白性,E中硫化钠与二氧化硫在酸性条件下生成硫,检验二氧化硫弱氧化性,由于二氧化硫可以污染大气,未反应的二氧化硫需要进行尾气处理,C装置中氢氧化钠可以吸收二氧化硫,导管深入四氯化碳中,可以防止倒吸.
解答 解:由实验目的可知,A为制备二氧化硫的发生装置,发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,D装置利用强酸制备弱酸原理检验其酸性氧化物的性质,B中溴水具有强氧化性,可以检验二氧化硫的还原性,二氧化硫与品红化合为无色物质,可以检验二氧化硫的漂白性,E中硫化钠与二氧化硫在酸性条件下生成硫,检验二氧化硫弱氧化性,由于二氧化硫可以污染大气,未反应的二氧化硫需要进行尾气处理,C装置中氢氧化钠可以吸收二氧化硫,导管深入四氯化碳中,可以防止倒吸,
(1)A中发生的反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)由上述分析可知,装置的接口连接顺序依次是a→f→e→c→b→g→h→d,
故答案为:f;e; c; b;
(3)E中硫化钠与二氧化硫在酸性条件下生成硫,检验二氧化硫弱氧化性,现象是:E试管中溶液变浑浊;
B中溴水具有强氧化性,可以检验二氧化硫的还原性,反应离子方程式为:SO2+Br2+2H2O=SO42-+2Br-+4H+,
故答案为:E试管中溶液变浑浊;SO2+Br2+2H2O=SO42-+2Br-+4H+;
(4)C试管中NaOH溶液的作用是:吸收未反应完的SO2,以免污染空气,CCl4的作用是:防止溶液倒吸,
故答案为:吸收未反应完的SO2,以免污染空气;防止溶液倒吸.
点评 本题考查二氧化硫的制备与性质探究实验,关键理解实验原理、明确各装置作用,侧重于学生的分析能力和实验能力的考查,难度不大.


科目:高中化学 来源: 题型:选择题
| A. |  利用图所示操作制备氢氧化铁胶体 | |
| B. | 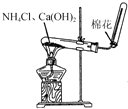 利用图所示装置制取NH3 | |
| C. |  利用图所示装置证明H2CO3酸性强于苯酚 | |
| D. |  利用图所示装置制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO3和BaSO4 | B. | BaS | C. | BaSO3 | D. | BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物理量 实验序号 | V(2.0mol/L KNO3)/ mL | … | |
| 1 | a | … | |
| 2 | a | … | |
| 3 | a | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com