
����ͼʾ���Ӧ������������ǣ���������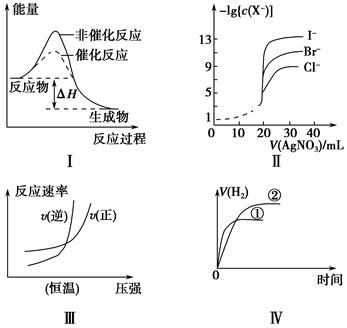
| A��ͼ���Ц�H��ʾijһ��Ӧ�������ķ�Ӧ����ͬ |
| B����0.010 0 mol��L��1����������Һ���ζ�Ũ�Ⱦ�Ϊ0.100 0 mol��L��1 Cl����Br����I���Ļ����Һ����ͼ�����ߣ���ȷ�����ȳ�������Cl�� |
| C��ͼ��ɱ�ʾ��ҵ�ϳɰ���Ӧ���¶�һ��������·�Ӧ������ѹǿ�Ĺ�ϵ |
| D��ͼ����ʾ��ͬ�������ͬpH��һԪǿ����Һ�ٺ�һԪ������Һ�ڷֱ���������п�۷�����Ӧ��V��H2����ʱ��ı仯���� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ҵ��������һ����Ҫ��Ӧ�ǣ�
��֪��25��ʱ��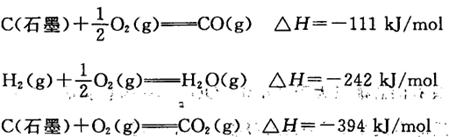
��2 5��ʱ1 mol CO��ˮ��������ת��Ϊ�����Ͷ�����̼��Ӧ��HΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����й��Ȼ�ѧ����ʽ��д����Ӧ��������ȷ����
| A���ܱ������У�9.6g�����11.2g���ۻ�ϼ�������������17.6 gʱ���ų�19.12 kJ��������Fe(s)��S(s)��FeS(s)��H����95.6kJ/mol |
| B��ϡ������0.1 mol/LNaOH��Һ��Ӧ��H��(aq)��OH��(aq)��H2O(l) ��H����57.3kJ/mol |
| C����֪1 mol������ȫȼ������Һ̬ˮ���ų�������Ϊ285.5 kJ����ˮ�ֽ���Ȼ�ѧ����ʽ��2H2O(l)��2H2(g)��O2(g)��H��+285.5kJ/mol |
| D����֪2C(s)+O2(g)��2CO(g)��H����221kJ/mol�����֪C��ȼ���ȡ�H��-110.5kJ/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����뻯ѧ��Ӧ�����仯��ص���������ȷ����( )
| A����Ӧ�Ⱦ��Ƿ�Ӧ�ų������� |
| B�����ȷ�Ӧ�ķ�Ӧ�������Ǵ������ȷ�Ӧ�ķ�Ӧ���� |
| C����ѧ��Ӧ�е��ʱ������ѧ�����Ѻ��γɵ������仯 |
| D��ͬ��ͬѹ�£�H2(g)��Cl2(g)��2HCl(g) ��H���ڹ��պ͵�ȼ�����·�Ӧ����H��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��2SO2(g)+O2(g) 2SO3(g)��H="-197" kJ��mol-1��ʵ����4 mol SO2�μ�������Ӧ�ų�354 kJ��������SO2��ת������ӽ���( )
2SO3(g)��H="-197" kJ��mol-1��ʵ����4 mol SO2�μ�������Ӧ�ų�354 kJ��������SO2��ת������ӽ���( )
| A��90% | B��80% | C��50% | D��40% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ����(����)
| A���κ��������кͷ�Ӧ����1 mol H2O�Ĺ����У������仯����ͬ |
| B��ͬ��ͬѹ�£�H2(g)��Cl2(g)=2HCl(g)�ڹ��պ͵�ȼ�����µĦ�H��ͬ |
| C����֪����2H2(g)��O2(g)=2H2O(g)��H����a kJ��mol��1�� ��2H2(g)��O2(g)=2H2O(l)��H����b kJ��mol��1����a>b |
| D����֪����C(s��ʯī)��O2(g)=CO2(g)��H����393.5 kJ��mol��1�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪����1 g��������������ȫȼ��������̬ˮ���ų�����120.9 kJ�����к���Ϊ57.3 kJ��mol��1����C(ʯīs)=C(���ʯs)����H����1.90 kJ��mol��1������˵����ȷ����(����)��
| A��������ȼ����Ϊ241.8 kJ��mol��1 |
| B������ȼ�յ��Ȼ�ѧ����ʽ��2H2��O2=2H2O����H����483.6 kJ��mol��1 |
| C������Ͱ�ˮ��ϵ��Ȼ�ѧ����ʽ��H��(aq)��OH��(aq)=H2O(l)����H����57.3 kJ��mol��1 |
| D���ɢۿ�֪���ʯ����ʯī�ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ͼ��N2��H2��Ӧ����NH3�Ĺ����������仯������ͼ������������ȷ����(����)��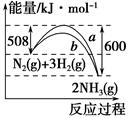
| A���÷�Ӧ���Ȼ�ѧ����ʽΪ N2(g)��3H2(g)=2NH3(g)����H����92 kJ |
| B��b�����Ǽ������ʱ�������仯���� |
| C������������û�ѧ��Ӧ�ķ�Ӧ�ȼ�С |
| D�����¶ȡ����һ���������£�ͨ��1 mol N2��3 mol H2��Ӧ��ų�������ΪQ1 kJ����ͨ��2 mol N2��6 mol H2��Ӧ��ų�������ΪQ2 kJ����184>Q2>2Q1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��H��(aq)��OH��(aq)=H2O(l)����H1����57.3 kJ��mol��1�� H2SO4(Ũ��aq)��NaOH(aq)=
H2SO4(Ũ��aq)��NaOH(aq)=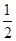 Na2SO4(aq)��H2O(l)����H2��m kJ��mol��1������˵����ȷ���� (����)��
Na2SO4(aq)��H2O(l)����H2��m kJ��mol��1������˵����ȷ���� (����)��
| A�������Ȼ�ѧ����ʽ�еĻ�ѧ��������ʾ���Ӹ��� |
| B����H1>��H2 |
| C����H2����57.3 kJ��mol��1 |
| D��|��H1|>|��H2| |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com