
【题目】下列有关原子核外电子排布的说法不正确的是 ( )。
A. 电子总是先排布在能量最低的电子层里
B. 每个电子层最多能容纳的电子数为2n2
C. 最外层电子数不超过8个(K为最外层时不超过2个)
D. S2-的M层电子数是K层电子数的3倍
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3与CH3CH2COOCH3为同一种物质
B.C70与14C互为同素异形体
C.乙醇易溶于水,丙三醇(甘油)难溶于水
D.2,2﹣二甲基丙烷的一氯代物只有一种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【吉林大学附属中学2017届第八次模拟考试】麻黄素是中枢神经兴奋剂,其合成路线如图所示。NBS是一种选择性溴代试剂。

已知:![]()
(1)其中A为烃,相对分子质量为92,A的结构简式是________________;
E中官能团的名称为___________________。
(2)反应B→C的反应条件和试剂是_______________,⑤的反应类型是________。
(3)F的结构简式是____________________________。
(4)写出C→D的化学方程式______________________________________。
(5)化合物F的芳香族同分异构体有多种,M和N是其中的两类,它们的结构和性质如下:
①已知M遇FeCl3溶液发生显色反应,能和银氨溶液发生银镜反应,苯环上只有两个对位取代基,则M的结构简式可能为___________________________________。
②已知N分子中含有甲基,能发生水解反应,苯环上只有一个取代基,则N的结构有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能液态燃料,其燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是
A. NA个偏二甲肼分子的质量为60g
B. 标准状况下,1mol偏二甲肼的体积约为22.4L
C. 偏二甲肼的摩尔质量为60g
D. 6g偏二甲肼分子中含有0.1NA个N2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是一种重要有机合成中间体,实验室可用如下反应合成:
C6H6+HNO3![]() C6H5—NO2+H2O ΔH<0
C6H5—NO2+H2O ΔH<0
已知:
①该反应在温度稍高的情况下会生成间二硝基苯。
②制备反应装置:

③有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 211 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)合成硝基苯的反应类型为_____________。
(2)制备时需要配制25 mL的浓硝酸和x mL(0.552 mol)浓硫酸(98%)混合液,混合酸应该盛放在_____________中(填写仪器名称),x值为_____________。
(3)反应在50℃~60℃下进行,其主要原因可能是__________________________(写两点即可),常用的方法是__________________________。
(4)反应完毕所得的硝基苯中混有无机物杂质,需将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液、水洗涤并分液,第二次用水洗的目的是__________________________。
(5)进行分液的硝基苯中含有少许水分及有机物杂质,加入无水aCl2颗粒,静置片刻,然后倒入蒸馏烧瓶,弃去CaCl2,最后进行蒸馏纯化,蒸馏纯化的实验方案为__________________________。从实验安全角度考虑,在蒸馏纯化过程中,应选用空气冷凝管,不选用通水的直形冷凝管的原因是__________________________________。
(6)若反应开始时向仪器A中加入19.5 mL苯,反应完毕提纯后得到20 g硝基苯,则实验所得到的硝基苯产率为_____________(精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,具有不稳定性,在400 ℃时开始分解产生多种气体,常用于生产火箭推进剂。某化学兴趣小组同学利用下列装置对NH4ClO4的分解产物进行探究。(假设装置内药品均足量,部分夹持装置已省略。)
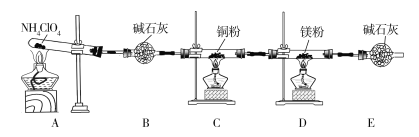
(1)在实验过程中发现C中铜粉由红色变为黑色,说明产物中有____________(填化学式)生成。
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,产生该气体的化学方程式为______________。
(3)通过上述实验现象的分析,某同学认为产物中还应有H2O,可能有Cl2。该同学认为可能有Cl2存在的理由是_________________________________。
(4)为了证明H2O和Cl2的存在,选择上述部分装置和下列提供的装置进行实验:
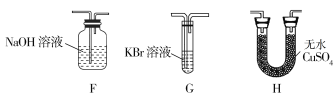
①按气流从左至右,装置的连接顺序为A→________→________→________。
②实验结束后发现G中液体变为橙黄色,用必要的文字和方程式解释出现该现象的原因:________________________。
③F中发生反应的离子方程式为___________________________。
(5)实验结论:NH4ClO4分解时产生了上述几种物质,则高氯酸铵分解的化学方程式为________________________________________________。
(6)在实验过程中仪器E中装有碱石灰的目的是________________;实验结束后,某同学拟通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,会造成计算结果__________(填“偏大”“偏小”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
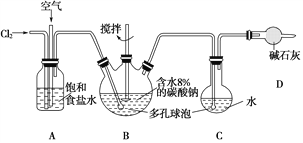
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气的体积比的方法是___________________________________。
②使用多孔球泡的作用是_____________________________________。
(2)①装置B中产生Cl2O的化学方程式为____________________________________。
②若B无冷却装置,进入C中的Cl2O会大量减少。其原因是___________________________。
(3)装置C中采用棕色圆底烧瓶是因为________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中所得次氯酸溶液的物质的量浓度的实验方案:用_________量取20.00 mL次氯酸溶液于烧杯中,_____________________________。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制80mL2.0mol/LNaOH溶液,其转移溶液的操作如图所示。
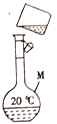
(1)图中操作上的错误是________。
(2)图中用到的仪器M是_______(填仪器名称和规格),下列关于仪器M的使用方法中,正确的是_______ (填字母)。
a.使用前应检查是否漏液 b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d.可直接将热溶液转移到其中
(3)该同学称取NaOH固体的质量为________。
(4)下列操作会使配制的溶液浓度偏高的是______(填字母)。
a.所用过的烧杯未洗涤
b.转移过程中有少量溶液溅出
c.摇匀后,液面下降,再加入水至刻度线
d.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A. 1mol NH4+含有的电子数目为11NA
B. 常温常压下,1.38g K2CO3含有的K+离子数为0.02NA
C. 标准状况下,11.2L CCl4含有的分子数为0.5NA
D. 100 mL 0.1 mol/LCH3COOH溶液中含有的H+离子数为0.01NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com