
| A.在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化 |
| B.我国决定推广使用车用乙醇汽油,乙醇汽油是一种新型的化合物,属于可再生能源 |
| C.制造航空服的“连续纤维增韧”材料主要成分由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 |
| D.“绿色荧光蛋白质”是由氨基酸加聚而成的高分子化合物 |
科目:高中化学 来源:不详 题型:单选题
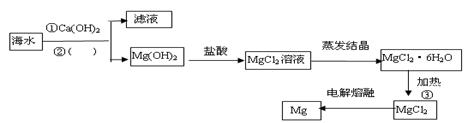
A.海水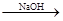 Mg(OH)2 Mg(OH)2 Mg Mg |
B.海水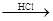 MgCl2溶液 MgCl2溶液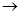 MgCl2熔融 MgCl2熔融 Mg Mg |
C.海水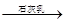 Mg(OH)2 Mg(OH)2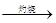 MgO MgO Mg Mg |
D.海水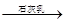 Mg(OH)2 Mg(OH)2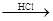 MgCl2溶液 MgCl2溶液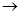 MgCl2熔融 MgCl2熔融 Mg Mg |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
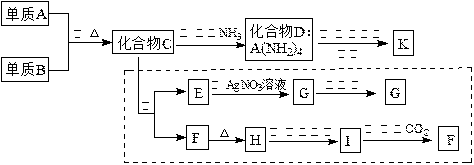
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
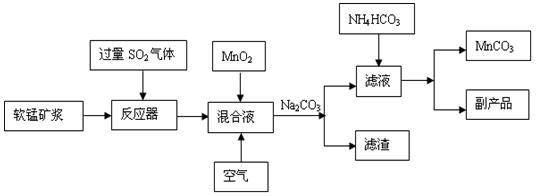
 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
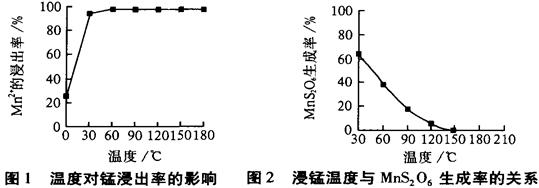
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
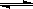 MnS2O6的△H 0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是 。
MnS2O6的△H 0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 的速度行驶了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列既可行又经济的制氢方法是 (填写编号)
的速度行驶了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列既可行又经济的制氢方法是 (填写编号) (4)今有两个氢气燃烧生成水的热化学方程式
(4)今有两个氢气燃烧生成水的热化学方程式 2H2(g)+ O2(g) ="=" 2H2O(g) △H=a kJ/mol
2H2(g)+ O2(g) ="=" 2H2O(g) △H=a kJ/mol 2H2(g)+ O2(g) ==2H2O(l) △H=b kJ/mol
2H2(g)+ O2(g) ==2H2O(l) △H=b kJ/mol
 ①若2 molH2完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)︱b︱kJ
①若2 molH2完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)︱b︱kJ 若已知拆开1mol氢气中的化学键要消耗436 kJ能量,拆开1mol氧气中的化学键要
若已知拆开1mol氢气中的化学键要消耗436 kJ能量,拆开1mol氧气中的化学键要 消耗496kJ能量,水蒸气中1molH—O键形成时放出热量463kJ,写出该反应的热化学方程式:
消耗496kJ能量,水蒸气中1molH—O键形成时放出热量463kJ,写出该反应的热化学方程式:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。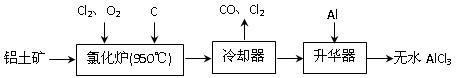
 的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
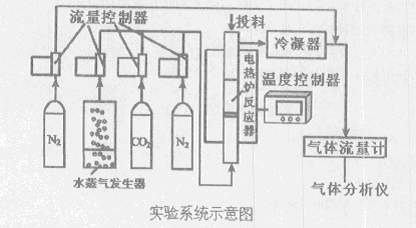
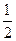 O2(g)=CO2(g) △H=-283kJ/mol
O2(g)=CO2(g) △H=-283kJ/mol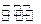 H2(g)+CO2(g)
H2(g)+CO2(g)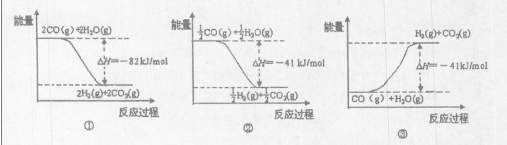
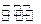 H2(g)+CO2(g)的平衡常数K=1,等物质的量的CO和H2O反应达到平衡时,CO的转化率为 .
H2(g)+CO2(g)的平衡常数K=1,等物质的量的CO和H2O反应达到平衡时,CO的转化率为 .查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com