
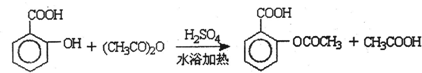
分析 (1)工业上利用水杨酸与醋酸酐反应制取阿司匹林;
(2)氨水和铜离子反应生成氢氧化铜沉淀,氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物;
(3)硫代硫酸钠溶液中加入稀硫酸变浑浊反应生成硫单质和二氧化硫和水;
(4)亚铁离子被酸性条件下硝酸根离子氧化成铁离子,同时生成NO气体;
(5)双氧水将碘离子氧化成碘单质.
解答 解:(1)工业上利用水杨酸与醋酸酐反应制取阿司匹林,反应方程式为: ,
,
故答案为: ;
;
(2)氨水和铜离子反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(3)硫代硫酸钠溶液中加入稀硫酸变浑浊,反应的离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O,
故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
(4)硝酸根离子在酸性条件下能够将亚铁离子氧化成铁离子,反应的离子方程式为:3Fe2+NO3-+4H+═3Fe3++2H2O+NO↑,
故答案为:3Fe2+NO3-+4H+═3Fe3++2H2O+NO↑;
(5)双氧水具有强氧化性,能够将碘离子氧化成碘单质,反应的离子方程式为:2H++H2O2+2I-=I2+2H2O,
故答案为:2H++H2O2+2I-=I2+2H2O.
点评 本题考查了离子方程式的书写,题目难度中等,明确离子反应发生实质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生灵活应用基础知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 洗去沾在手上的敌敌畏用碱性肥皂较好 | |
| B. | 洗去沾在手上的敌敌畏用中性香皂较好 | |
| C. | 敌敌畏极易溶于水 | |
| D. | 敌敌畏可以发生加成反应,不能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中,NO3-、Na+、I-、Fe2+ | |
| B. | pH=13的溶液中,Cl-、Mg2+、CH3COO-、K+ | |
| C. | 水电离出的c(H+)=1×10-12mol•L-1溶液中,HCO3-、SO42-、Na+、NH4+ | |
| D. | pH=14的无色透明溶液中,K+、Na+、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将纯水加热至较高温度,水的离子积变大,pH减小,呈酸性 | |
| B. | 碱性氢氧燃料电池工作时,OH-向正极迁移 | |
| C. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H>0 | |
| D. | 用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
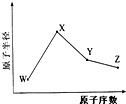 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com