(1)在200℃、101kPa时,1gH
2与碘蒸气完全反应放出7.45kJ的热量,请写出该反应的热化学方程式
H
2(g)+I
2(g)
2HI(g)△H(473K)=-14.9kJ?mol
-1H
2(g)+I
2(g)
2HI(g)△H(473K)=-14.9kJ?mol
-1(2)乙醇的燃烧热△H=-1366.8kJ?mol
-1,试写出表示乙醇的燃烧热的热化学方程式
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ?mol-1
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ?mol-1
.
(3)已知:①CH
4(g)+
O
2(g)=CO(g)+2H
2(g)△H
1=-35.6kJ?mol
-1②CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(g)△H
2=-890.3kJ?mol
-1③CH
4(g)+CO
2(g)=2CO(g)+2H
2(g)△H
3=+247.3kJ?mol
-1上述三个反应中属于熵增反应的是
①③
①③
;请结合上述三个反应写出CH
4和H
2O(g)生成CO和H
2的热化学反应方程式
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+250.3kJ?mol-1
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+250.3kJ?mol-1
.



 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案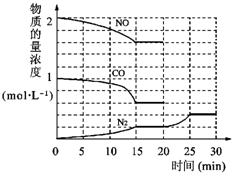 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素. O2+Hb?CO
O2+Hb?CO N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
 科学家一直致力于“人工固氮”的新方法研究.
科学家一直致力于“人工固氮”的新方法研究.