
【题目】已知:①R—![]() —
—![]()
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是_______________________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________________,②____________________________。
(3)B在苯环上的二氯代物有 种同分异构体。
(4)有机物 的所有原子 (填“是”或“不是”)在同一平面上。
的所有原子 (填“是”或“不是”)在同一平面上。
【答案】 (3)6 (4)不是
(3)6 (4)不是
【解析】
由题中信息可知,苯与混酸发生硝化反应生成硝基苯,然后硝基苯与一氯甲烷发生取代反应生成间硝基甲苯,间硝基甲苯发生还原反应生成间甲基苯胺;苯与溴发生取代反应生成溴苯,溴苯再与浓硫酸反应生成对溴苯磺酸,对溴苯磺酸与氢气发生加成反应生成![]() ;根据题中定位基效应的信息可知,苯与发生卤代反应生成卤苯(氯苯或溴苯),卤苯再发生硝化反应生成对溴硝基苯,对溴硝基苯发生水解生成对硝基苯酚。
;根据题中定位基效应的信息可知,苯与发生卤代反应生成卤苯(氯苯或溴苯),卤苯再发生硝化反应生成对溴硝基苯,对溴硝基苯发生水解生成对硝基苯酚。
(1)A转化为B的化学方程式是 。
。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①![]() ,②
,②![]() 。
。
(3)B在苯环上的的4个H原子分别用1、2、3、4标记如图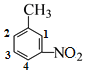 ,则其二氯代物有1、2位取代、1、3位取代、1、4位取代、2、3位取代、2、4位取代和3、4位取代,共有6种同分异构体(组合算法
,则其二氯代物有1、2位取代、1、3位取代、1、4位取代、2、3位取代、2、4位取代和3、4位取代,共有6种同分异构体(组合算法![]() =
=![]() )。
)。
(4)根据甲烷分子的正四面体结构,可以判断有机物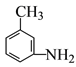 的所有原子不可能在同一平面上。
的所有原子不可能在同一平面上。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于甲烷、乙烷、丙烷的说法正确的是( )
A. 它们的分子空间结构都是正四面体B. 都能使酸性高锰酸钾溶液褪色
C. 光照条件下,都能与氯气发生取代反应D. 乙烷的熔、沸点比丙烷高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,集气瓶内充满某气体,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体可能是

①NH3 ②N2、H2 ③NO2、O2 ④SO2 ⑤SO2、Cl2
A. ①②③④⑤ B. ①②④ C. ①③④⑤ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、铅盐在现代工业中有着重要的用途。
(1)工业利用锌冶炼过程中的铅浮渣生产硫酸铅的流程如下[已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。

①生产过程中,必须使浸出渣中仍含少量的铅单质,其目的是_________,废液中存在可循环利用于的物质,该物质是_______ , 加40%硫酸的目的是 _______
②写出酸浸过程中单质铅反应的化学方程式:______,若沉淀物含有极少量CaSO4,则洗涤剂最好使用____
a.水 b.10%硫酸、水 c.Pb(NO3)2溶液、水
(2)已知铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2以及Pb3O4。Pb3O4能与硝酸发生非氧化还原反应生成一种盐和一种铅的氧化物,写出反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振谱(NMR)是研究有机化合物结构的最有力手段之一。在所研究化合物的分子中,每一种结构类型的等价(或称为等性)H原子,在NMR谱中都给出相应的峰(信号).谱中峰的强度是与分子中给定类型的H原子数成比例的。例如,乙醇的NMR谱中有三个信号,其强度比为3:2:1。
(1)在常温下测得的某烃C8H10(不能与溴水反应)的NMR谱上,观察到两种类型的H原子给出的信号,其强度之比为2:3,试确定该烃的结构简式为________________________;该烃在光照下生成的一氯代物在NMR谱中可产生_________种信号,强度比为__________。
(2)在常温下测定相对分子质量为128的某烃的NMR,观察到两种类型的H原子给出的信号,其强度之比为9:1,若为链烃,则该烃的结构简式为________________,其名称为_______________。观察到两种类型的H原子给出的信号,其强度之比为1:1,若为芳香烃,则该烃的结构简式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D均为短周期元素,它们的原子序数依次递增。 A是最外层为一个电子的非金属元素,C 原子的最外层电子数是次外层的3倍; C和D可形成两种固态化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物。A、B、C三种元素可以形成离子晶体,该晶体中各元素原子的物质的量之比为A:B:C=4:2:3。
请回答下列问题:
(1)写出B的原子结构示意图______,写出C和D形成的淡黄色固体化合物的电子式_____。
(2)元素原子的物质的量之比为A:B:C=4:2:3的晶体名称为__________。
(3)请写出与A2C和BA3分子中电子数相同,且仍由A、B、C元素中任意两种元素组成的微粒的符号(举两例)____、_____。
(4)写出由B、C元素组成且元素原子质量比为B:C=7:12的化合物的化学式 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:

(1)写出下列元素符号:① _________,⑥_________,⑦_______。
(2)画出原子的结构示意图:④__________,⑧____________。
(3)在①~12元素中,金属性最强的元素是______,非金属性最强的元素是____,最不活泼的元素是_____。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是___(填序号),跟它同周期原子半径最小的元素是__(填序号),它们可以形成____(填离子或共价)化合物,用电子式表示其形成过程:____。(6)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程:_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界里常见金属元素存在最多的是Al,其次是铁,接着是铜。然而铜冶炼出来的时间却比铝要早的多,究其原因,最合理的解释是( )
A.铜矿较易还原,铝矿很难还原
B.铜矿较易氧化,铝矿很难氧化
C.铜矿颜色较深,易发现,铝矿颜色较浅,不易发现
D.矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是 ( )
A. F2、Cl2、Br2、I2的氧化性逐渐增强
B. VIA族元素的原子,其半径越大,越容易得到电子
C. 同周期元素中,VIIA族元素的原子半径最大
D. 元素周期表中从IIIB到IIB的10个纵列的元素都是金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com