
【题目】甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系![]() 其它产物已略去
其它产物已略去![]() 。
。
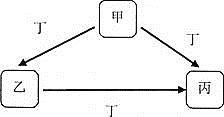
![]() 若丁为KOH溶液,写出乙的一种用途________,甲
若丁为KOH溶液,写出乙的一种用途________,甲![]() 丙的离子方程式为________。
丙的离子方程式为________。
![]() 若丁为Fe,写出向丙溶液中加入NaOH溶液的化学方程式:________;该实验现象为________。
若丁为Fe,写出向丙溶液中加入NaOH溶液的化学方程式:________;该实验现象为________。
![]() 若甲、乙、丙均为焰色反应呈黄色的化合物,则丁可能为________。
若甲、乙、丙均为焰色反应呈黄色的化合物,则丁可能为________。
【答案】![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ,
,![]() 生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐色
生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐色 ![]() 或
或![]()
【解析】
(1)若丁为KOH溶液,甲可为氯化铝,乙为氢氧化铝,丙为偏铝酸钠;
(2)若丁为Fe,甲可为硝酸,乙为硝酸铁,丙为硝酸亚铁;
(3)若甲、乙、丙均为焰色反应呈黄色的化合物,甲可为NaOH,丁可为CO2,乙为碳酸钠,丙为碳酸氢钠,如丁为SO2,乙为亚硫酸钠,丙为亚硫酸氢钠,以此解答该题。
(1)若丁为KOH溶液,根据题意,甲能和氢氧化钾反应,同时和丁反应可以分步,故甲为可溶性铝盐,氢氧化钾少量生成氢氧化铝沉淀,再滴加氢氧化钾沉淀溶解生成偏铝酸根离子,故乙为氢氧化铝,用途为医用胃酸中和剂;甲直接生成丙,是氢氧化钾过量直接生成偏铝酸根离子和水,离子方程式为:![]() ;故答案为:医用胃酸中和剂;
;故答案为:医用胃酸中和剂;![]() ;
;
(2)若丁为铁,说明甲为硝酸,铁不足生成乙为硝酸铁,铁过量生成丙为硝酸亚铁,铁离子和铁反应生成亚铁离子,硝酸亚铁和氢氧化钠反应生成氢氧化亚铁沉淀,氢氧化亚铁不稳定,很容易被氧气氧化为氢氧化铁,产生的现象为:生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐色;故答案为:![]()
![]()
![]()
![]()
![]()
![]() ;
;![]() 生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐色;
生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐色;
(3)若甲、乙、丙均为焰色反应呈黄色的化合物,说明含有钠元素,甲可以是氢氧化钠,丁可以是二氧化碳或二氧化硫,乙为碳酸钠或亚硫酸钠,丙为碳酸氢钠或亚硫酸氢钠,故答案为:![]() 或
或![]() ;
;


科目:高中化学 来源: 题型:
【题目】工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O,根据题意完成下列填空:
(1) 在上述反应的反应物和生成物中,属于非极性分子的电子式______,属于弱酸的电离方程式______。
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是______(选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为______。
(4) Na2CO3俗称纯碱,属于______晶体。工业上制取纯碱的原料是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+2B2(g)![]() 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol A2、2molB2 | 2molAB3 | 2mol AB3 |
反应物的转化率 | a甲 | a乙 | a丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时AB3的反应速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列说法正确的是( )
A.v甲=v丙B.c乙<c丙C.a甲 +a乙<1D.K乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(g)cC(g)+dD(g)△H,根据图象判断,下列叙述正确的是( )

A.p1<p2,a+b<c+d,T1<T2,△H>0
B.p1<p2,a+b>c+d,T1>T2,△H>0
C.p1<p2,a+b<c+d,T1>T2,△H>0
D.以上答案均不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=____,C=____,E=_____.
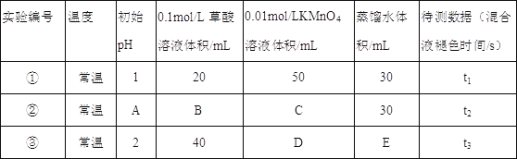
(2)该反应的离子方程式______________________________________.
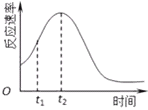
(3)若t1<t2,则根据实验①和②得到的结论是_____________________________.
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①__________________;②__________________________.
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:______________________________;实验中所需的定量仪器有__________________(填仪器名称).该KMnO4溶液的物质的量浓度为____mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:

(1)上表的6种酸进行比较,酸性最弱的是:_____;HCOO-、S2-、HSO3-三种离子中,最难结合H+的是__________。
(2)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:_________。
(3)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:___。
(4)下列离子方程式书写正确的是________。
A.HNO2+HS-=NO2-+H2S↑
B.2HCOOH+SO32-=2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32-
D.H2SO3+SO32-=2HSO3-
E.H2C2O4+NO2-=HC2O4-+HNO2
(5)将少量的SO2通入Na2C2O4溶液,写出离子方程式___。
(6)已知HX为一元弱酸。HX的电离常数为5.5×10﹣8。某混合溶液中含有4molNaX、2molNa2CO3和1molNaHCO3。往溶液中通入3molCO2气体,充分反应后,气体全部被吸收,计算某些物质的量:Na2CO3______、NaHCO3______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL![]()
![]() 溶液中滴加
溶液中滴加![]() NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是
NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是
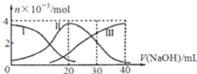
A.滴加过程中当溶液呈中性时,![]()
B.当![]() 时,则有:
时,则有:![]()
C.H![]() 在水中的电离方程式是:H
在水中的电离方程式是:H![]() ;
;![]()
D.当![]() 时,则有:
时,则有:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的焓变通常用实验进行测定,也可理论推算,回答下列问题。
(1)实验测得,1 g CH3OH(l)在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量,试写出甲醇燃烧的热化学方程式_______________________________________。
(2)已知某工业生产中甲烷与水蒸汽存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) △H1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) △H2
iii.CH4(g)=C(s)+2H2(g) △H3
……
Iii为积炭反应,利用△H1和△H2计算△H3时,还需要利用_____________反应的△H。(写化学方程式)
(3)氯化氢转化为氯气的催化过程如下:
CuCl2(s)=CuCl(s)+![]() Cl2(g) △H1=+83 kJ·mol-1
Cl2(g) △H1=+83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) △H2=-20 kJ·mol-1
Cl2(g) △H2=-20 kJ·mol-1
CuO(s)+2HCl(g)= CuCl2(s)+H2O(g) △H3=-121 kJ·mol-1
则4HCl(g)+ O2(g)= 2Cl2(g)+2H2O(g)的△H=___________kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com