
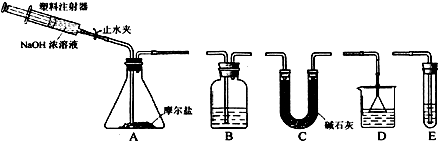
 如图是实验室制取并探究氯气化学性质的装置图
如图是实验室制取并探究氯气化学性质的装置图分析 实验室用加热二氧化锰与浓盐酸的方法制取氯气,浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气,要收集干燥纯净的氯气,应依次通过盛有饱和食盐水和浓硫酸的洗气瓶,氯气密度大于空气密度,用向上排空气法收集,氯气具有强氧化性,能够氧化二价铁离子、碘离子,氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸和水,据此解答.
解答 解:(1)实验室用加热二氧化锰与浓盐酸的方法制取氯气,所以圆底烧瓶发生反应方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+C12↑;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+C12↑;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,选择盛有饱和食盐水的洗气瓶除去氯化氢;
故答案为:除去氯气中的氯化氢;
(3)浓硫酸具有吸水性,可以干燥氯气,要制备纯净干燥氯气,可选择浓硫酸干燥;
故答案为:浓硫酸;
(4)氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸和水,可以选择盛有氢氧化钠溶液的烧杯进行尾气处理;
故答案为:氢氧化钠溶液;
(5)氯气有强氧化性,能把二价铁离子氧化为三价铁离子自身被还原为氯离子2Fe2++Cl2=2Fe3++2Cl-; 能把碘离子氧化为碘单质,碘遇淀粉变蓝色,所以会看到无色溶液显蓝色.
故答案为:2Fe2++Cl2=2Fe3++2Cl-; 无色溶液显蓝色;
(6)只有有压强差时溶液才能从分液漏斗中流下,所以分液漏斗的上口用导管a与烧瓶相连的作用是平衡气压,使分液漏斗中的液体顺利下滴;
故答案为:平衡气压,使分液漏斗中的液体顺利下滴;
(7)12mol•L-1的浓盐酸100mL含有氯化氢物质的量为12mol/L×0.1L=1.2mol,依据方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+C12↑,若氯化氢完全反应则生成氯气物质的量为0.03mol,而实际生成标准状况下的氯气4.48L,物质的量为0.2mol,所以盐酸的利用率为$\frac{0.2mol}{0.3mol}$×100%=66.7%;
故答案为:66.7%.
点评 本题考查了氯气的实验室制法及化学性质,难度不大,熟悉氯气的实验室制备原理及氯气的性质是解题关键,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 将XZ2通入W单质与水反应后的溶液中,一定只生成一种盐 | |
| C. | 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键 | |
| D. | CaZ、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡吸热反应均需在加热条件下才能发生 | |
| B. | 离子化合物中不可能含有共价键 | |
| C. | 液氨作为清洁能源的反应原理是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O | |
| D. | 实验收集NO和乙烯常用排水法不能用排空气法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀Na0H溶液除去乙酸乙酯中的乙酸 | |
| B. | 一定条件下可以用H2除去乙烷中混有的乙烯 | |
| C. | 蒸馏时温度计的水银球应插入液面之下 | |
| D. | 酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后,即可注入待测液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯的一氯代物 | B. | 分子式为C5H10的烯烃 | ||
| C. | 相对分子质量为74的一元醇 | D. | 立方烷( )的二硝基取代物 )的二硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na+、SO42-、Cu2+、Cl- | B. | Fe2+、Na+、OH-、K+ | ||
| C. | K+、CO32-、Cl-、Ag+ | D. | H+、Cl-、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com