
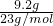 =0.4mol,5.4g Al的物质的量为
=0.4mol,5.4g Al的物质的量为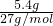 =0.2mol,首先发生反应2Na+2H2O═2NaOH+H2↑,生成NaOH为0.4mol,再发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol-0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为
=0.2mol,首先发生反应2Na+2H2O═2NaOH+H2↑,生成NaOH为0.4mol,再发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol-0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为 =0.3mol,首先发生反应NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol-0.2mol=0.1mol,再发生反应NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl,
=0.3mol,首先发生反应NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol-0.2mol=0.1mol,再发生反应NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl, 计算.
计算.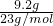 =0.4mol,5.4g Al的物质的量为
=0.4mol,5.4g Al的物质的量为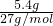 =0.2mol,首先发生反应2Na+2H2O═2NaOH+H2↑,生成NaOH为0.4mol,再发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol-0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为
=0.2mol,首先发生反应2Na+2H2O═2NaOH+H2↑,生成NaOH为0.4mol,再发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol-0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为 =0.3mol,首先发生反应NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol-0.2mol=0.1mol,再发生反应NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl,
=0.3mol,首先发生反应NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol-0.2mol=0.1mol,再发生反应NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl, =0.2mol,铝与氢氧化钠反应生成氢气为0.2mol×
=0.2mol,铝与氢氧化钠反应生成氢气为0.2mol×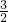 =0.3mol,故生成氢气的体积为(0.2mol+0.3mol)×22.4L/mol=11.2L,故C错误;
=0.3mol,故生成氢气的体积为(0.2mol+0.3mol)×22.4L/mol=11.2L,故C错误;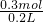 =1.5mol/L,故D正确;
=1.5mol/L,故D正确;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
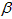 -锂辉石(主要成分为Li2O
-锂辉石(主要成分为Li2O Al2O3
Al2O3 4SiO2)为原材料制备
4SiO2)为原材料制备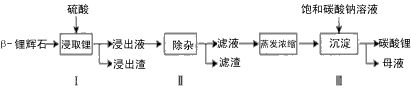
 -锂辉石要粉碎成细颗粒的目的是_____________.
-锂辉石要粉碎成细颗粒的目的是_____________.查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
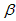 -锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原材料制备
-锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原材料制备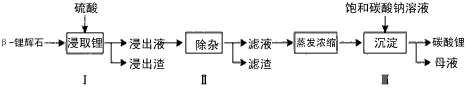
 -锂辉石要粉碎成细颗粒的目的是_____________。
-锂辉石要粉碎成细颗粒的目的是_____________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com