
����Ŀ�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã��ϳɰ���ҵ�ڹ�������������Ҫ���塣�����ǹ��ںϳɰ����й����⣬��ش�
��1������һ�ݻ�Ϊ2 L���ܱ������м���0.2 mol��N2��0.6 mol��H2����һ�������·�����Ӧ�� N2(g) ��3H2(g)![]() 2NH3(g)����H<0������5����ʱ��Ӧ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2 mol����ǰ5���ӵ�ƽ����Ӧ����v(N2)��________��
2NH3(g)����H<0������5����ʱ��Ӧ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2 mol����ǰ5���ӵ�ƽ����Ӧ����v(N2)��________��
��2��ƽ�����Ҫ���H2��ת���ʣ����Բ�ȡ�Ĵ�ʩ��________��
A�����˴��� B������������� C�����ͷ�Ӧ��ϵ���¶� D������һ����N2
��3������0.5 L���ܱ������У�һ�����ĵ����������������·�Ӧ��N2(g)��3H2(g)![]() 2NH3(g)����H<0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����ʾ��
2NH3(g)����H<0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����ʾ��
T/�� | 200 | 300 | 400 |
K | K1 | K3 | 0.5 |
������������⣺
���ԱȽ�K1��K2�Ĵ�С��K1________K2(����<������>����������)��
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________(�������ĸ)
A��������N2��H2��NH3�����ʵ���Ũ��֮��Ϊ1��3��2
B��v(H2)����3v(H2)��
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
��400��ʱ����Ӧ2NH3(g)![]() N2(g)��3H2(g)�Ļ�ѧƽ�ⳣ��Ϊ________�������NH3��N2��H2���ʵ����ֱ�Ϊ3 mol��2 mol�� 1 molʱ����÷�Ӧ��v(N2)��________v(N2)��(����<������>����������)��
N2(g)��3H2(g)�Ļ�ѧƽ�ⳣ��Ϊ________�������NH3��N2��H2���ʵ����ֱ�Ϊ3 mol��2 mol�� 1 molʱ����÷�Ӧ��v(N2)��________v(N2)��(����<������>����������)��
��4�����ݻ�ѧ��Ӧ���ʺͻ�ѧƽ�����ۣ���ϵ�ϳɰ�������ʵ�ʣ�����Ϊ����˵������ȷ����________��
A����ѧ��Ӧ�������ۿ�ָ��������һ��ʱ���ڿ����Ʒ
B����������ԭ����ָ������ʹ������ԭ�϶����Ʒ
C��������ʹ������߲�Ʒ���ʵ���Ч����
D����ȷ���û�ѧ��Ӧ���ʺͻ�ѧ��Ӧ�����۶�����������������ۺϾ���Ч��
���𰸡� 0.01 mol��L��1��min��1 C��D > C 2 > C
����������1��5min��ƽ�⣬��c��NH3��=0.1mol/L������v��NH3��=![]() �����ݷ�Ӧ����֮�ȵ���ϵ��֮�ȣ���v��N2��=
�����ݷ�Ӧ����֮�ȵ���ϵ��֮�ȣ���v��N2��=![]() ��0.02mol/��Lmin��=0.01mol/��Lmin����
��0.02mol/��Lmin��=0.01mol/��Lmin����
�ʴ�Ϊ��0.01mol/��Lmin����
��2��A���Ӵ���ֻ�ܸı仯ѧ���ʣ����ܸı仯ѧƽ�⣬���������ת���ʣ�A����B�����������������������ѹǿ��С��ƽ�������ƶ���H2��ת���ʼ�С��B����C�������¶ȣ�ƽ������ȷ�Ӧ�����ƶ���������Ӧ�����ƶ���H2��ת��������C��ȷ��D������һ����N2��ƽ�������ƶ���H2��ת��������D��ȷ��
�ʴ�Ϊ��C��D;
��3�����÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ���������Ũ�ȼ�С����Ӧ��Ũ����������K1��K2��
�ʴ�Ϊ������
��A�������ڸ����ʵ�Ũ��֮�ȵ��ڼ�����֮�ȣ�����֤�����淴Ӧ������ȣ���A����B����ͬ���ʵ����淴Ӧ����֮�ȵ����������֮����ƽ��״̬��3�ԣ�N2��������=�ԣ�H2�����棩��ƽ��״̬����B����C��������ѹǿ���䣬��������ʵ������䣬�÷�Ӧ��ƽ��״̬����C��ȷ��D����������ܱ������з�Ӧ���������䣬������䣬�ܶ�ʼ�ղ��䣬��D������
�ʴ�Ϊ��C��
��400��ʱ����Ӧ2NH3��g��N2��g��+3H2��g���Ļ�ѧƽ�ⳣ��K��ֵ�ͷ�ӦN2��g��+3H2��g��2NH3��g����ƽ�ⳣ���ʵ���������K=![]() =2��
=2��
���������Ϊ0.5L��NH3��N2��H2�����ʵ���Ũ�ȷֱ�Ϊ��6mol/L��4mol/L��2mol/L��400��ʱ��Ũ����Qc=![]() ��K=2��˵����Ӧ������У������v��N2������v��N2������
��K=2��˵����Ӧ������У������v��N2������v��N2������
�ʴ�Ϊ��2������
��4���Ӵ���ֻ�ܸı仯ѧ���ʣ�����ͨ���Ӵ�����������ʱ�䣬�������Ч�ʣ����������ܸı�ʹ��ѧƽ���ƶ������Բ��ܸı�ת���ʡ����ʡ���C����


 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ԫ�ض�����p�����ǣ� ��
A. ԭ������Ϊ1��6��10��Ԫ�� B. N��S��P
C. Na��Li��Mg D. Fe��Cr�� Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ���ں���Pb2����Sn2����ij��Һ�����������������(Sn)��������Ӧ��Sn(s)��Pb2��(aq) ![]() Sn2��(aq)��Pb(s)����ϵ��c(Pb2��)��c(Sn2��)�仯��ϵ��ͼ��ʾ�������ж���ȷ����( )
Sn2��(aq)��Pb(s)����ϵ��c(Pb2��)��c(Sn2��)�仯��ϵ��ͼ��ʾ�������ж���ȷ����( )
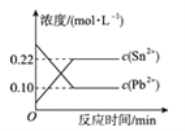
A. ��ƽ����ϵ�м������Ǧ��c(Pb2��)����
B. �����¶ȣ�ƽ����ϵ��c(Pb2��)����˵���÷�Ӧ��H��0
C. 25 ��ʱ���÷�Ӧ��ƽ�ⳣ��K��2.2
D. ��ƽ����ϵ�м�������Sn(NO3)2�����c(Pb2��)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ָ����Һ��һ���ܴ���������ǣ� ��
A. ������Һ�У�Al3+��Ba2+��Cl-��NO3-
B. �����£�pH=1����Һ�У�K+��Fe2+��MnO4-��I-
C. ��ʹ���ȱ�Ϊ��ɫ����Һ�У�Na+��Al3+��Cl-
D. �����£�![]() =1��10-12����Һ�У�K+��Na+��CO32-��NO3-
=1��10-12����Һ�У�K+��Na+��CO32-��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪4NH3��g��+5O2��g��4NO��g��+6H2O��g����H��0�������й�������ȷ�ģ� ��
A.������Ӧ�Ļ�ѧ��Ӧ���ʹ�ϵ��2 v��NH3��=3 v��H2O��
B.����2L���ܱ������з�Ӧ������3min��NH3�����ʵ�����10mol��Ϊ7mol ��v ��NH3��=0.5molL��1s��1
C.�ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ�С���淴Ӧ��������
D.�������¶ȣ���Ӧ���ʽ����С��ƽ�⽫���ƻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߣ���������������Ϣ���ɣ������±��ж�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼۣ��ش��������⣮
�� | �� | �� | �� | �� | �� | �� | �� | |
ԭ�Ӱ뾶��10��10m�� | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
�����ͻ��ϼ� | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
��2 | ��3 | ��1 | ��3 |
��1������Ԫ������Ԫ�آദ��ͬһ���ڵ�������Ԫ�ط��ţ�
��2��Ԫ�آ���Ԫ�����ڱ��е�λ����
��3���٢ܢ�����Ԫ�ص��⻯����ȶ�����ǿ������˳��Ϊ���ѧʽ��
��4����д������Ԫ���γɵij���������ĵ���ʽ�� �ۢ��ڢ��ۢ�
��5����д���ݢ�����Ԫ�ص�����������Ӧˮ����䷴Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A. 0.1mol/L��ˮ�У�c(OH-)=c(NH4+)
B. �ڳ����£�10mL 0.02mol/L HCl��Һ��10mL 0.02mol.LBa(OH)2��Һ��ֻ��,����Ϻ���Һ�����Ϊ20mL,����Һ��pH=12
C. ������ˮ��c(Cl-)=c(ClO-)+c(HClO)
D. 0.1mol/L KHC2O4��Һ������,��Һ��c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����������й�����Ũ��֮��Ĺ�ϵ�������
A. ��0.2mol/L NaHCO3��Һ��0.1mol/L KOH��Һ��������:3c(K+) +c(H+)=c(OH-) +c(HCO3-) +2c(CO32-)
B. Ũ�Ⱦ�Ϊ0.1mol/L ��CH3COOH ��CH3COONa��Һ�������Ϻ�pH=5,������Һ��:c(CH3COO-)-c(CH3COOH)=2��(10-5-10-9) mol/L
C. ��CO2ͨ��0.1mol/L Na2CO3��Һ�����ԣ���Һ��2c (CO32-) + c (HCO3-)=0.1mol/L
D. Ka(CH3COOH)=Kb(NH3��H2O) =1.8��10-5��������0.1mol/L CH3COONH4��c(CH3COO-):c(NH3��H2O)=180
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��һ�������£�ƽ�ⳣ��������
2NO2![]() N2O4 K1 NO2
N2O4 K1 NO2![]() 1/2N2O4K2 N2O4
1/2N2O4K2 N2O4![]() 2NO2 K3
2NO2 K3
�Ƶ�K1��K2,K1��K3�Ĺ�ϵ�ֱ�Ϊ:______________��
��2����������������ָ����:���ԡ�ѡ���ԡ��ȶ��ԡ��۸�ȡ����ڸ��������·�Ӧ��֮���ܹ�ͬʱ���������Ӧ�����,����Ĵ������Դ�������Ŀ����������ղ����е�____(����������������������ת����)���������������ԣ���������________�ԡ�
��3����Һ��pH��Cr2O72-�����ʵ�Ӱ������ͼ��ʾ��
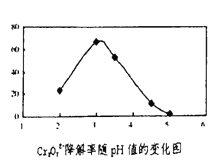
��֪:Cu2O![]() Cu+CuSO4��
Cu+CuSO4��
����Խ��Cr2O72-����ԭ��Խ��
��������ͼ��֪��pH�ֱ�Ϊ2��3��4 ʱ��Cr2O72-�Ľ�������õ���______����ԭ����______��
�ڰ���ͼ����10��Ũ���ᣬ��Һ�ɳȻ�ɫ��Ϊ��ɫ�����ϻ�ѧ������ƽ���ƶ�ԭ��������ԭ��_____��
��4��һ�������½�̿���Ի�ԭNO2,��ӦΪ:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)���ں��µ��ܱ������£�6molNO2������C �����÷�Ӧ�����ƽ��ʱNO2�����ʵ�����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ:
N2(g)+2CO2(g)���ں��µ��ܱ������£�6molNO2������C �����÷�Ӧ�����ƽ��ʱNO2�����ʵ�����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ:
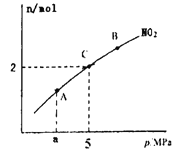
��C��NO2��ת���ʺ�C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp=(K,����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)�ֱ�Ϊ______��_______��
��5����֪��CO����CO2�Ļ�ѧ����ʽΪCO+O2![]() CO2+O��������Ӧ����Ϊv��=K��c(CO)��c(O2),�淴Ӧ����Ϊv��=K��c(CO2)��c(O),K����K��Ϊ���ʳ�������2500K�£�K��=1.21��105 L��s-1��mol-1,K��=3.02��105L��s-1��mol-1������¶���������Ӧ��ƽ�ⳣ��KֵΪ_______(����С�����һλС��)��
CO2+O��������Ӧ����Ϊv��=K��c(CO)��c(O2),�淴Ӧ����Ϊv��=K��c(CO2)��c(O),K����K��Ϊ���ʳ�������2500K�£�K��=1.21��105 L��s-1��mol-1,K��=3.02��105L��s-1��mol-1������¶���������Ӧ��ƽ�ⳣ��KֵΪ_______(����С�����һλС��)��
��6������ˮú���ϳɶ����ѵ�������Ӧ����:
��2H2(g) + CO(g) ![]() CH3OH(g); ��H1
CH3OH(g); ��H1
��CH3OH(g) ![]() CH2OCH3(g) + H2O(g); ��H2
CH2OCH3(g) + H2O(g); ��H2
��CO(g) + H2O(g) ![]() CO2(g) + H2(g); ��H3
CO2(g) + H2(g); ��H3
�ܷ�Ӧ: 3H2(g)+3CO(g) ![]() CH2OCH3(g)+CO2(g)����H=_______��
CH2OCH3(g)+CO2(g)����H=_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com