
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:①将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;②将一定量的淀粉水解液加入三颈烧瓶中;③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3、98%H2SO4的质量比为2:1.5)溶液;④反应3h左右,冷却,过滤后再重结晶得草酸晶体。
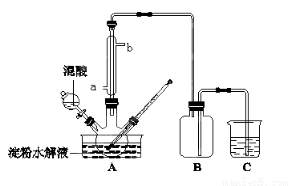
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的目的是: 。
(2)冷凝水从a口进入,但实验中若混酸滴加过快,将导致草酸产量下降,其原因是 。
(3)检验淀粉是否水解完全所用的试剂为 。
(4) 当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NOx全部吸收,发生的化学反应方程式为: 。
(5) 将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为 。滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。

(1) 加快淀粉水解的速度(或起到催化剂的作用)(2分)
(2) 温度过高 、硝酸浓度过大,导致H2C2O4进一步被氧化 (2分)
(3) 碘水或KI-I2 溶液 (2分)
(4) NO2+NO+2NaOH=2NaNO2+H2O (2分)
(5)溶液颜色由无色变为紫红色(或淡紫色),且半分钟内不褪色(2分) 84.0% (2分)
【解析】
试题分析:(1)实验①在1∶1的淀粉水乳液中加入98%硫酸少许的目的是:加快淀粉水解的速度(或起到催化剂的作用);(2)冷凝水从a口进入,可以使物质充分冷凝,但实验中若混酸滴加过快,温度过高 、硝酸浓度过大,导致H2C2O4进一步被氧化将导致草酸产量下降;(3)若淀粉水解完全,则溶液中就不存在淀粉,因此检验所用的试剂为碘水或KI-I2 溶液,若不变为蓝色,则水解完全,否则未完全水解;(4) 当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NOx全部吸收,发生归中反应,发生的化学反应方程式为NO2+NO+2NaOH=2NaNO2+H2O;(5) 酸性KMnO4溶液为紫色的,当不断滴入与草酸发生反应而消耗时,溶液的紫色会褪去,若草酸完全反应掉,滴入的高锰酸钾就不能发生反应,这时溶液为紫色,因此滴定至终点时滴定终点的现象为溶液颜色由无色变为紫红色(或淡紫色),且半分钟内不褪色;根据图示可知消耗酸性KMnO4溶液的体积为18.60ml-2.60ml=16.00ml,n(MnO4-)=0.020 mol/L×0.016L=3.2×10-4mol。根据反应方程式2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O可知n(H2C2O4)=5/2 n(MnO4-)=5/2×3.2×10-4mol=8×10-4mol,所以m(H2C2O4·2H2O)= 8×10-4mol× 126g/mol = 0.1008g,所以该草酸晶体样品中二水合草酸的质量分数为(0.1008g÷0.12 g)×100%= 84.0%。
考点:考查淀粉的水解条件的控制、物质的检验、滴定终点的判断、化学方程式的书写、物质纯度的计算。


科目:高中化学 来源:2015届浙江省高二下学期期中化学试卷(解析版) 题型:选择题
香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下图所示。下列说法正确的是
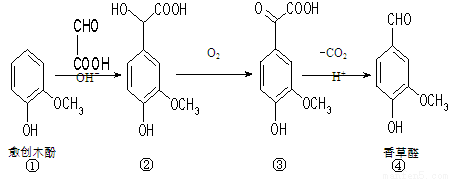
A.在上述三步反应中理论上只有①生成②的反应原子利用率为100%
B.氯化铁溶液和碳酸氢钠溶液都能鉴别③④
C.②分子中C原子不可能在同一平面上
D.等物质的量的①②分别与足量NaOH溶液反应,消耗NaOH的物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高二下学期期中考试化学试卷(解析版) 题型:实验题
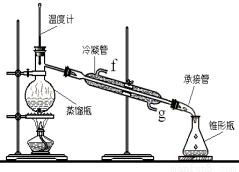
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇为主要原料制备环己烯。
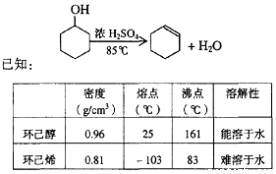
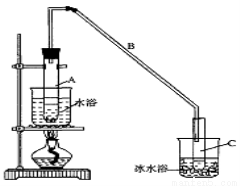
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入(填“g”或“f”)。收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________________________
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
下列各组中的反应,属于同一反应类型的是( )
A.乙烯水化制乙醇;溴乙烷水解制乙醇
B.甲苯使酸性高锰酸钾溶液褪色;丙炔使溴的四氯化碳溶液褪色
C.乙醇脱水制乙烯;溴乙烷与NaOH乙醇溶液共热制乙烯
D.苯的硝化;苯与氢气(镍作催化剂)制取环己烷
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
下列有机物的命名正确的是( )
A.3,3—二甲基丁烷 B.3—甲基—2—乙基戊烷
C.1,1—二氯乙烯 D.2,3—二甲基戊烯
查看答案和解析>>
科目:高中化学 来源:2015届浙江省“温州八校”高三返校联考化学试卷(解析版) 题型:选择题
下列溶液中各微粒的浓度关系正确的是
A.室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+)
B.将10 mL 0.l mol·L-1 Na2CO3溶液逐滴滴加到10 mL 0.l mol·L-1盐酸中:
c(Na+) >c(Cl-) >c(HCO3-) >c(CO32-)
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+) = c(K+) = c(Ba2+)
D.0.2 mol·L-1的某一元弱酸HA溶液和0.l mol·L-1NaOH溶液等体积混合后的溶液:
2c(OH-) + c(A-) = 2c(H+) + c(HA)
查看答案和解析>>
科目:高中化学 来源:2015届浙江省“温州八校”高三返校联考化学试卷(解析版) 题型:选择题
在平衡体系:CaCO3(s)  CaO(s) + CO2中仅含有碳酸钙、氧化钙及二氧化碳气体。原压强为P,体积为V,在t0时刻,将容器体积缩小为原来的一半并保持不变。若固体所占体积可忽略,且温度维持不变,则此体系中压强(P 纵坐标)跟时间(t 横坐标)的关系为
CaO(s) + CO2中仅含有碳酸钙、氧化钙及二氧化碳气体。原压强为P,体积为V,在t0时刻,将容器体积缩小为原来的一半并保持不变。若固体所占体积可忽略,且温度维持不变,则此体系中压强(P 纵坐标)跟时间(t 横坐标)的关系为

查看答案和解析>>
科目:高中化学 来源:2015届河南长葛第三实验高中高二下学期第一次考试化学试卷(解析版) 题型:实验题
电石中的碳化钙和水能完全反应: CaC2+2H2O=C2H2↑+Ca(OH)2,使反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积,从而可测定电石中碳化钙的含量。
(1)若用下列仪器和导管组装实验装置:
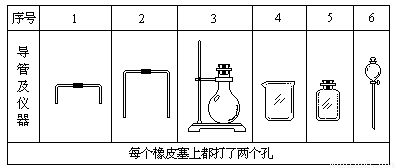
如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是:( )接( )接( )接( )接( )接( )。
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。
③在仪器6和5中注入适量水。
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不发生气体时,关闭活塞。
正确的操作顺序(用操作编号填写)是 。
(3)若实验产生的气体有难闻的臭鸡蛋这是因为含有 杂质。检验此杂质的反应为 。
(4)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数是 %。
查看答案和解析>>
科目:高中化学 来源:2015届河南省顶级名校高三入学定位考试化学试卷(解析版) 题型:选择题
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是 ( )
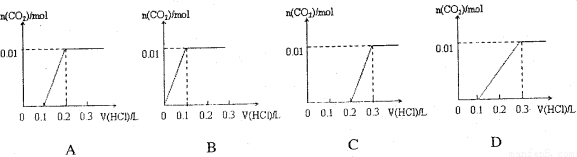
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com