
|
德国化学家哈伯因为在合成氨方面的巨大贡献获得诺贝尔化学奖,时隔多年后,诺贝尔化学奖再次垂青于合成氨有关的研究.合成氨是人类科学技术发展史上的一项重大突破,它不仅解决了地球上因粮食不足而导致的饥饿和死亡问题,同时也大大提高了硝酸和火药的产量.下列说法中不正确的是 | |
| [ ] | |
A. |
氮气与氢气在点燃或光照下可以合成氨 |
B. |
氨极易溶于水,水溶液呈碱性 |
C. |
氨遇浓盐酸时会发生反应产生白烟 |
D. |
在氨与氧气反应的过程中,氮元素被氧化 |
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
X、Y、Z均为短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气体),Y+Z→B(气体)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,A和B化合时有白烟产生,德国化学家哈伯因为研究A的工业合成曾两度获得诺贝尔奖,则:
①有人说,哈伯解决了全世界人的吃饭问题,请你说说对这句话的理解 。
②A与氧气反应生成C和D,是化工生产上的重要反应,写出该反应的化学方程式 ,C是大气污染物,说出一种C造成污染的现象 ,
③将C与A混合,在一定条件下可转化为无毒的X和D,该反应中氧化产物与还原产物的质量之比为 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是 ;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是 ;
③将Y与(1)中Z单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:高三模拟考试化学试题(三) 题型:填空题
X、Y、Z均为短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气体),Y+Z→B(气体)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,A和B化合时有白烟产生,德国化学家哈伯因为研究A的工业合成曾两度获得诺贝尔奖,则:
①有人说,哈伯解决了全世界人的吃饭问题,请你说说对这句话的理解 。
②A与氧气反应生成C和D,是化工生产上的重要反应,写出该反应的化学方程式 ,C是大气污染物,说出一种C造成污染的现象 ,
③将C与A混合,在一定条件下可转化为无毒的X和D,该反应中氧化产物与还原产物的质量之比为 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是 ;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是 ;
③将Y与(1)中Z单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:北京期中题 题型:填空题
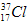 的中子数为______,该氯原子与
的中子数为______,该氯原子与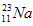 原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。
原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com