
| A. | 分解反应 | B. | 置换反应 | C. | 复分解反应 | D. | 化合反应 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从食盐溶液中获得食盐晶体采用蒸馏的方法 | |
| B. | 将碘晶体中含有的少量沙子除去采用蒸馏的方法 | |
| C. | 除去酒精中含有的较多量水采用蒸馏的方法 | |
| D. | 从碘水中获得碘的晶体采用过滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32gO2含2NA个原子 | |
| B. | 标准状况下,11.2LH2O含有的原子数目为1.5NA | |
| C. | 1mol的Cl-含有NA个电子 | |
| D. | 0.5mol/L的NaCl溶液中Cl-的个数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯乙烯(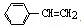 )中含有的C=C数为4NA )中含有的C=C数为4NA | |
| B. | 标准状况下,2.24L己烷含有的分子数为0.1NA | |
| C. | 1mol甲基含10NA个电子 | |
| D. | 某温度下,2.6g乙炔和苯的混合气体中所含碳原子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com