
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对反应速率的影响; c.实验①和④探究催化剂对反应速率的影响. |
| ② | ||||
| ③ | 0.010 | |||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| Ⅰ | 14.0 | 13.0 | 11.0 |
| Ⅱ | 6.5 | 6.7 | 6.8 |
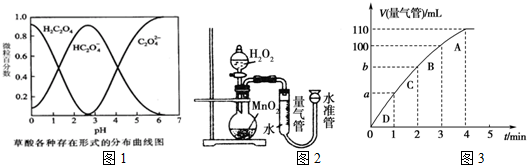
分析 (1)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据氧化还原反应得失电子守恒配平反应方程式;
(2)根据实验的目的和影响化学反应速率的因素来设计实验;
(3)①根据0.01KMnO4酸性溶液前后三次褪色时间差距较大,应舍去,所以用0.001KMnO4酸性溶液三次褪色来计算:先求出反应开始时c(KMnO4),然后求出三次褪色的平均时间,最后根据ν(KMnO4)=$\frac{△c}{△t}$进行计算;
②根据KMnO4的物质的量不同来分析;
(4)酸性条件下,高锰酸根离子能将氯离子氧化成氯气;
(5)①根据图象确定生成氧气的体积;
②图象斜率的大小反映反应速率快慢,斜率越大,反应速率越快,将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,由于反应物浓度减小,反应速率减小,3min~4min生成10mL气体,那么2min~3min生成气体的体积应大于10mL,故b小于90mL.
解答 解:(1)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=1OCO2↑+2Mn2++8H2O;
(2)由实验目的可知,探究浓度、温度、接触面积对化学反应速率的影响,
实验①和②探究KMnO4酸性溶液的浓度对反应速率的影响,则实验①②的温度、催化剂的用量相同,只有浓度不同;实验①③的温度不同,则实验目的是探究温度对化学反应速率的影响,则①③中只有温度不同,其他条件相同;实验①④应该是探究催化剂对反应速率的影响,则①④中只有催化剂的用量不同,其他条件相同,据此完成表格为:
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | b.③ c.④ | |||
| ② | 298 | 0.5 | 0.0010 | |
| ③ | 323 | 0.5 | ||
| ④ | 298 | 0 | 0.010 |
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | b.③ c.④ | |||
| ② | 298 | 0.5 | 0.0010 | |
| ③ | 323 | 0.5 | ||
| ④ | 298 | 0 | 0.010 |
点评 本题主要结合实验考查了外界条件对化学反应速率的影响,反应速率的计算,图象和表格的信息量大,平时要多练习,培养较强的分析问题、解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
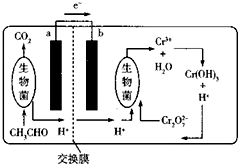 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )| A. | b极为正极,发生还原反应 | |
| B. | 负极的电极反应式为CH3CHO-10e-+3H2O═2CO2↑+10H+ | |
| C. | 理论上处理l mol Cr2O72-时有l4mool H+从交换膜左侧向右侧迁移 | |
| D. | 放电时,交换膜右侧生物菌周围溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
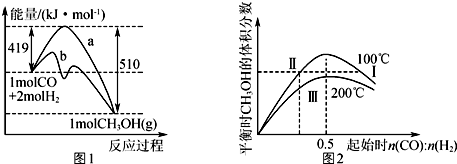
| A. | 正反应的△H=91 kJ•mol-1,曲线b表示使用了催化剂 | |
| B. | 正反应速率v正:v正(状态Ⅱ)<v正(状态Ⅲ) | |
| C. | 平衡时CO的转化率:α(CO,状态Ⅰ)<α(CO,状态Ⅱ) | |
| D. | n(CO):n(H2)=0.5时,平衡时CH3OH的物质的量浓度:c(CH3OH,1 00℃)<c(CH3OH,200℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
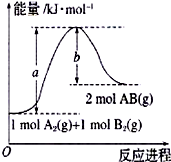 (1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 混合溶液/实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
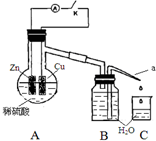 该同学用如下装置进行实验,分析影响反应速率的因素.
该同学用如下装置进行实验,分析影响反应速率的因素.| 实验Ⅰ(断开K)1分钟水滴数 | 34 | 59 | 86 | 117 | … | 102 |
| 实验Ⅱ(闭合K)1分钟水滴数 | 58 | 81 | 112 | 139 | … | 78 |
| A. | 实验Ⅰ中化学能主要转化为热能 | |
| B. | 实验Ⅱ中化学能主要转化为电能 | |
| C. | 反应前期水滴数58>34、81>59,主要原因是实验Ⅱ中形成原电池加快反应速率 | |
| D. | 反应后期水滴数102>78,主要原因是实验Ⅰ溶液温度高于实验Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素的原子半径以 VIIA 族的为最大 | |
| B. | 在周期表中零族元素的单质全部是气体 | |
| C. | IA、IIA 族元素的原子,其半径越大就越容易得电子 | |
| D. | 所有主族元素的最高正价数都和它的族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 通入过量的O2可以使SO2转化率达到100% | |
| C. | 升高温度可以增大反应速率 | |
| D. | 增大O2浓度可以增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | CO2通入苯酚钠溶液:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com