
设NA为阿伏加德罗常数的值,下列叙述不正确的( )
| A.10g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA |
| B.5.6 g铁与足量硫加热充分反应转移电子数为 0.2NA |
| C.50 mL 12 mol?L-1浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D.标准状况下,含有1mol硫原子的SO2 与SO3的混合物,其体积小于22.4L |
D
解析试题分析:A.10g质量分数为46%的乙醇溶液中,乙醇的质量是10g×46%=4.6g.n(乙醇)=4.6g46g/mol=0.1mol.由乙醇的分子式C2H6O可看出氢原子的物质的量为0.6mol.所以氢原子的总数为0.6NA。正确。B.硫的氧化性较弱,只能把变价金属Fe氧化成+2价。所以5.6 g铁即0.1mol的与足量硫加热充分反应转移电子数为 0.2NA。正确。C.二氧化锰加热时只能和浓盐酸发生反应。n(HCl)="0.05L" ×12 mol/L=0.6mol.所以反应进行到一定程度后,浓盐酸变为稀盐酸,这时反应就不再进行。所以转移电子数小于0.3 NA。错误。D.标准状况下,SO3呈固态。所以含有1mol硫原子的SO2 与SO3的混合物,其体积小于22.4L。正确。
考点:考查关于物质的量的化学计算的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
下列化学用语正确的是
A.中子数为20的氯原子: |
| B.硫酸的电离方程式:H2SO4=H2++SO42— |
| C.漂白粉的有效成分:CaCl2 |
| D.明矾的化学式:KAl(SO4)2?12H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在V mL Al2(SO4)3溶液中含有Al3+m g,取V/4 mL该溶液用水稀释至4V mL,则SO42-物质的量浓度为
A.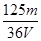 mol/L mol/L | B.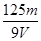 mol/L mol/L | C. mol/L mol/L | D.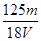 mol/L mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设NA为阿佛加德罗常数的数值,下列说法正确的是
| A.常温常压下,8gO2含有4NA个电子 |
| B.1L1mol·L-1的NaClO 溶液中含有ClO-的数目为NA |
| C.标准状况下,22.4L盐酸含有NA个HCl分子 |
| D.1molNa被完全氧化生成Na2O2,失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
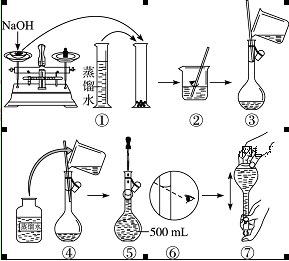
配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
| A.使用滤纸称量氢氧化钠固体 |
| B.容量瓶中原来存有少量蒸馏水 |
| C.溶解NaOH的烧杯未经多次洗涤 |
| D.胶头滴管加水后定容时仰视刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3 NA |
| B.25℃时,pH=13的1.0 LBa(OH)2溶液中含有的OH-数目为0.2 NA |
| C.常温常压下,4. 4gCO2和N2O混合物中所含有的原子数为0.3 NA |
| D.标准状况下,2. 24LCl2通入足量H2O或NaOH溶液中转移的电子数均为0.1 NA。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
若NA表示阿伏加德罗常数,下列说法正确的是
| A.1 mol Na2O2与水反应时,转移电子的数目为2 NA |
| B.标准状况下,22.4 L水中含有水分子的数目为NA |
| C.14 g N2中含有电子的数目为7 NA |
| D.数目为NA的一氧化碳分子和0.5 mol甲烷的质量比为7︰4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
两种金属混合物粉末12g,与足量的盐酸反应生成标准状况下11.2L氢气,符合上述情况的金属混合物是
| A.Mg、Fe | B.Zn、Ag | C.Al、Zn | D.Mg、Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com