
【题目】2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
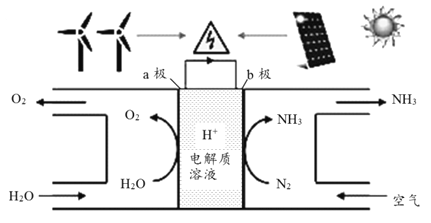
下列说法正确的是
A. 图中能量转化方式只有2种
B. H+向a极区移动
C. b极发生的电极反应为:N2+6H++6e-== 2NH3
D. a极上每产生22.4L O2流过电极的电子数为4NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】己知AgCl在水中的溶解是吸热过程。不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示。己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是

A. T1>T2
B. a =4.0×10-5
C. M点溶液温度变为T1时,溶液中Cl-的浓度不变
D. T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL1的盐酸,测得溶液中的CO32、HCO3、AlO2、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法正确的是( )(已知:H2CO3的电离平衡常数K1 = 4.3×107,K2 = 5.6×1011;Al(OH)3的酸式电离平衡常数K=6.3×1013)
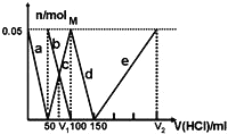
A. a曲线表示的离子方程式为:AlO2+4H+ = Al3+ + 2H2O
B. M点时生成的CO2为0.05 mol
C. 原混合溶液中的CO32与AlO2的物质的量之比为1:2
D. V1:V2=1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
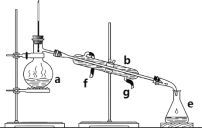
(1)写出下列仪器的名称:a.____________,b.___________,c.__________。
(2)仪器a~e中,使用前必须检查是否漏水的有___________。(填序号)
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在_______处。冷凝水由____口流出(填f或g)。
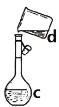
(4)现需配制0.1mol/LNaOH溶液450mL,装置是某同学转移溶液的示意图。
①图中的错误是_____________________________。
②根据计算得知,所需NaOH的质量为_______。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_____________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作___________;容量瓶用蒸馏洗涤后残留有少量的水_____________;若定容时俯视刻度线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机化合物分子式的一种重要方法。已知 0.1mol 某烃 A完全燃烧后,生成 11.2L(标准状况)的![]() ,生成 10.8g 水,回答下列问题。
,生成 10.8g 水,回答下列问题。
(1)通过计算推导A的分子式_____________(写出计算过程)。
(2)写出A可能的结构简式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,K=![]() =1.75×10-5,其中K是该温度下CH3COOH的电离平衡常数。下列说法正确的是( )
=1.75×10-5,其中K是该温度下CH3COOH的电离平衡常数。下列说法正确的是( )
A.向该溶液中加入一定量的硫酸,K增大
B.升高温度,K增大
C.向CH3COOH溶液中加入少量水,K增大
D.向CH3COOH溶液中加入少量氢氧化钠溶液,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中___________区;第二周期元素中,第一电离能比氧大的有___________种。
(2)O3可用于消毒。O3的中心原子的杂化形式为___________;其分子的 VSEPR模型为___________,与其互为等电子体的离子为___________(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为___________;C2H5OH不能用无水CaCl2千燥是因为Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,该离子的结构式可表示为______________________。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为___________;与O2-紧邻的所有Fe2+构成的几何构型为___________。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com