

 .
.分析 (1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应可以制备G为H2SiO3;
(3)若A是CO2气体,CO2与NaOH溶液能够反应生成碳酸钠或碳酸氢钠或两者的混合物,也有可能氢氧化钠过量,根据反应后所得的溶液再与盐酸反应产生气体的图2所示可知,盐酸体积为0.1L时没有气体,而用了0.2L的盐酸产生气体,碳酸钠溶液生成碳酸氢钠的用掉的盐酸与碳酸氢钠产生二氧化碳用的掉的盐酸相等,由此判断反应后溶液中的溶质;
(4)若A是一种化肥,实验室可用A和NaOH反应制取气体E,则E为NH3、A为铵盐,E与氯气相遇均冒白烟,且利用E与氯气的反应检验输送氯气的管道是否泄露,则氨气与氯气反应生成氯化铵,同时生成氮气.
解答 解:(1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,用惰性电极电解M溶液的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,HCl分子中H原子与Cl原子之间形成1对共用电子对,其电子式为: ,
,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应可以制备G为H2SiO3,E的溶液俗称水玻璃,
故答案为:水玻璃;
(3)若A是CO2气体,CO2与NaOH溶液能够反应生成碳酸钠或碳酸氢钠或两者的混合物,也有可能氢氧化钠过量,根据反应后所得的溶液再与盐酸反应产生气体的图2所示可知,盐酸体积为0.1L时没有气体,而用了0.2L的盐酸产生气体,碳酸钠溶液生成碳酸氢钠的用掉的盐酸与碳酸氢钠产生二氧化碳用的掉的盐酸相等,由此判断反应后溶液中的溶质为Na2CO3和NaHCO3,
故答案为:Na2CO3和NaHCO3;
(4)若A是一种化肥,实验室可用A和NaOH反应制取气体E,则E为NH3、A为铵盐,E与氯气相遇均冒白烟,且利用E与氯气的反应检验输送氯气的管道是否泄露,则氨气与氯气反应生成氯化铵,同时生成氮气,反应方程式为:3Cl2+8NH3=N2+6NH4Cl,
故答案为:3Cl2+8NH3=N2+6NH4Cl.
点评 本题考查无机物推断等,题目涉及元素化合物较多,需要学生全面掌握据基础知识,注意(3)中根据图象判断溶质的组成,难度中等.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2O3(g)=3O2(g)△H<0 | B. | 2CO(g)=2C(s)+O2(g)△H>0 | ||
| C. | N2(g)+3H2(g)=2NH3(g)△H<0 | D. | CaCO3(s)=CaO(s)+CO2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO${\;}_{3}^{-}$═CO${\;}_{3}^{2-}$+H+ | B. | NaHSO4═Na++HSO4- | ||
| C. | H3PO4?3H++PO${\;}_{4}^{3-}$ | D. | NH3•H2O?NH${\;}_{4}^{+}$+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取25.20gNaOH | |
| B. | 将称好的NaOH固体放入容量瓶中加入少量水溶解 | |
| C. | 未冷却就将烧杯中的NaOH溶液注入容量瓶中会导致溶液浓度偏高 | |
| D. | 定容时,液面超过了容量瓶刻度线,用胶头滴管吸出刻度线以上的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制乙烯时,在酒精和浓硫酸的混合液中,放入几片碎瓷片,加热混合物,使液体温度迅速升到170℃ | |
| B. | 实验室制取肥皂时,待植物油、乙醇和氢氧化钠溶液的混合物加热充分反应后,冷却,用纱布滤出固态物质 | |
| C. | 验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置,待液体分层后,滴加硝酸银溶液 | |
| D. | 验证蔗糖水解产物时,在蔗糖溶液中加入几滴稀硫酸,水浴5 min,加入新制银氨溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
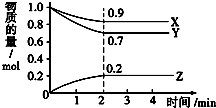 某温度时,在2L密闭容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com