

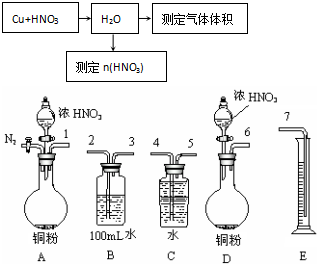
分析 (1)双氧水具有氧化性,在酸性环境下能将金属铜氧化;用电解原理实现铜和盐酸的反应,根据电解原理来选择合适的电解装置;
(2)①一氧化氮不溶于水,易被氧气氧化;实验方案验证Cu与浓硝酸反应的过程中可能产生NO,装置中不含氧气,可以用惰气赶出;
②测定生成NO体积,依据一氧化氮气体的性质分析可以用排水量气装置测定,铜和浓硝酸反应生成二氧化氮气体,需要用水吸收二氧化氮和挥发出的硝酸;
③依据内外压强相同来准确测定气体体积;
(3)依据化学方程式进行,结合硫铁矿质量计算需要氧气的物质的量,根据氧气的条件分数计算空气体积.
解答 解:(1)双氧水具有氧化性,在酸性环境下能将金属铜氧化,化学方程式为:Cu+H2O2+2HCl=CuCl2+2H2O,用电解原理实现铜和盐酸的反应,根据电解原理阳极必须是金属铜,电解质必须是稀盐酸,作图:以铜为阳极,以盐酸为电解质溶液的电解池装置.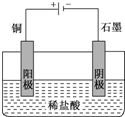
故答案为:Cu+H2O2+2HCl=CuCl2+2H2O; ;
;
(2)①一氧化氮不溶于水,易被氧气氧化;实验方案验证Cu与浓硝酸反应的过程中可能产生NO,装置中不含氧气,选A装置,其中氮气不和一氧化氮反应,可以起到把装置中的空气赶净的作用,防止一氧化氮被氧气氧化;
故答案为:A;因为A装置可以通N2将装置中的空气排尽,防止NO被空气中O2氧化;
②组合一套可用来测定生成NO体积的装置,需要显通过水吸收挥发出的硝酸和生成的二氧化氮气体,然后用排水量气的方法测定生成的一氧化氮;依据装置导气管的连接顺序,洗气应长进短处,量气应短进长出,故答案为:123547;
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置升高,以保证量筒中的液面与集气瓶中的液面持平,保持内外大气压相同,
故答案为:升高;
(3)工业制硫酸时,硫铁矿(FeS2)高温下空气氧化产生二氧化硫:4FeS2+11O2=8SO2+2Fe2O3,设空气中N2、O2的含量分别为0.800和0.200(体积分数),4.8t FeS2完全制成硫酸,设硫铁矿完全反应需要氧气物质的量为X;二氧化硫物质的量为Y;二氧化硫氧化为三氧化硫需要氧气物质的量为Z;
4FeS2+11O2=8SO2+2Fe2O3,
4×120 11 8
4.8×106g X Y
X=1.1×105mol
Y=8×104mol
2SO2+O2=2SO3
2 1
8×104 Z
Z=4×104mol
空气的体积=$\frac{(1.{1}^{4}+4×1{0}^{4})×22.4}{0.2}$L=1.68×107L
故答案为:1.68×107.
点评 本题考查了物质性质的分析判断和实验设计验证、原电池设计,主要是铜和浓硝酸反应生成的一氧化氮气体的测定实验设计,实验装置的连接,化学方程式的计算方法,题目难度中等.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-COOH | B. | CH2=CH-CH2OH | C. | CH2=CH-CHO | D. | CH2=CH-COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Fe2+、SO42-、NO3- | B. | Al3+、Na+、HCO-3、Cl- | ||
| C. | Fe3+、K+、Cl-、SCN- | D. | K+、SO2-4,Na+、NO-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成1mol Fe3O4,反应转移的电子总数为3mol | |
| B. | Fe2+和S2O32-都是还原剂 | |
| C. | 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol | |
| D. | x=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:15 | B. | 1:1:13 | C. | 1:2:13 | D. | 2:13:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com