
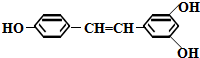 ,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )
,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )| A. | 13种 | B. | 15种 | C. | 17种 | D. | 19种 |
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
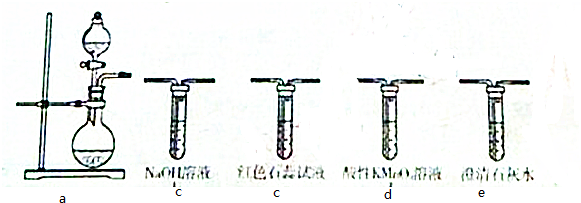
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,甲失电子比乙失电子多 | |
| B. | 甲在化合物中的化合价比乙在化合物中的高 | |
| C. | 甲能与稀盐酸反应生成氢气,而乙不能 | |
| D. | 甲与乙组成原电池时,甲为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
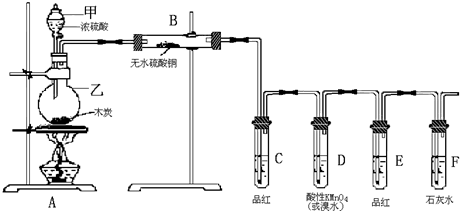
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ③④⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该溶液中:Na+、SO42-、CH2O、Mg2+可以大量共存 | |
| B. | 该溶液中Fe3+的检验:Fe3++3SCN-=Fe(SCN)3↓ | |
| C. | 与NaHCO3溶液混合:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑ | |
| D. | 每腐蚀32gCu需要1mol/L该溶液500mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com