
| A. | SO2+2Fe3++2H2O═SO42-+2Fe2++4H+ | |
| B. | I2+2Fe2+═2I-+2Fe3+ | |
| C. | SO2+I2+2H2O═2I-+4H++SO42- | |
| D. | 少量Cl2通入FeI2溶液中:Cl2+2I-═2Cl-+I2 |
分析 根据氧化还原反应的强弱规律,氧化剂的氧化性大于氧化产物;还原剂的还原性大于还原产物;对比选项中的反应进行分析判断;
解答 解:A、反应中还原剂SO2的还原性大于还原产物Fe2+,符合题给条件,反应能进行,故A不选;
B、反应中还原剂Fe2+的还原性小于还原产物I-,不符合氧化还原反应规律,反应不能进行,故选B;
C、反应中还原剂二氧化硫-的还原性大于还原产物I-,符合题给条件,反应能进行,故C不选;
D、离子还原性I->Fe2+,反应先和氯气反应,反应中还原剂I-的还原性大于还原产物Cl-,反应能进行,故D不选;
故选B.
点评 本题考查了氧化还原反应的强弱规律的应用,主要准确判断还原剂和还原产物,概念实质和氧化还原反应规律是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入足量氢氧化钠溶液后产生的浑浊不溶解 | |
| B. | 用pH试纸检验呈弱酸性 | |
| C. | 滴入KSCN溶液后溶液变血红色 | |
| D. | 溶液显浅黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.2% | B. | 30.0% | C. | 75.7% | D. | 80.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的焓变为△H=+(a-b) kJ/mol | |
| B. | 加入催化剂只能减小a而不能改变b的大小 | |
| C. | 加入催化剂可使反应热效应逆转,从而易于进行 | |
| D. | 断裂1molA-A和1molB-B键,放出a kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g冰中最多含有氢键的数目为4NA | |
| B. | 0.1L3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| C. | 7.8gNa2O2中阴、阳离子总数为0.4NA | |
| D. | 4.5gSiO2晶体中含有的硅氧键数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | KI淀粉溶液中滴入氯水,再通入SO2 | 先变蓝色后褪色 | SO2有漂白性 |
| B | 用洁净铂丝蘸取无色溶液进行焰色反应 | 火焰呈黄色 | 无色溶液为钠盐溶液 |
| C | 向白色ZnS沉淀上滴加0.1mol/LCuSO4溶液 | 沉淀变为黑色 | Ksp(ZnS)>Ksp(CuS) |
| D | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
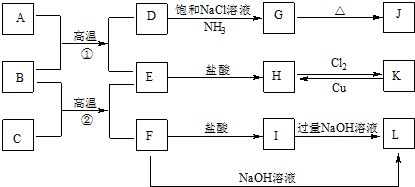
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com