
【题目】下列说法正确的是
A. 浓盐酸、浓硫酸、浓硝酸均属于强电解质
B. SiO2、SO2、SO3均属于酸性氧化物
C. 根据是否具有丁达尔效应,将分散系分为溶液、胶体和浊液
D. 纯碱的分子式是Na2CO3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】“瘦肉精”是一种能减少脂肪增加瘦肉的药品,有很危险的副作用,轻则导致心律不齐,重则导致心脏病。下列关于两种常见瘦肉精的说法不正确的是( )
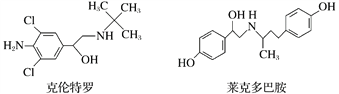
A. 克伦特罗分子的分子式为C12H18ON2Cl2
B. 克伦特罗能发生加成、氧化、消去等反应
C. 克伦特罗和莱克多巴胺可以用FeCl3溶液鉴别
D. 莱克多巴胺与足量NaOH溶液反应,生成物的化学式为C18H20NO3Na3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在实验室制取乙酸乙酯的主要步骤如下:①在大试管A中配制反应混合液;②按图甲所示连接好装置(装置气密性良好),用小火均匀加热大试管A 5~10 min;③待试管B收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置,待分层;④分离出乙酸乙酯层,洗涤、干燥。

已知:乙醇可以和氯化钙反应,生成微溶于水的CaCl2·6C2H5OH;无水硫酸钠易吸水形成硫酸钠结晶水合物。
有关试剂的部分数据如下:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) |
| 338.0 | 1.84 |
(1)配制反应混合液的主要操作步骤为_______________________(不必指出液体体积);制取乙酸乙酯的化学方程式为________________。
(2)上述实验中饱和Na2CO3溶液的作用是________(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.减小乙酸乙酯的溶解度,有利于其分层析出
D.加速乙酸乙酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要原因之一是温度过高会发生副反应,另一个原因是________________________________________________________。
(4)写出步骤③中观察到的现象___________________________。
(5)分离出乙酸乙酯层后,一般用饱和CaCl2溶液洗涤。通过洗涤可除去的杂质是________(填名称);干燥乙酸乙酯可选用的干燥剂为________(填字母)。
A.P2O5 B.无水硫酸钠
C.碱石灰 D.NaOH固体
(6)某化学课外小组设计了图乙所示的制取乙酸乙酯的装置(图中铁架台、铁夹、加热装置均已略去),与图甲装置相比,图乙装置的主要优点有________(填字母)。

a.增加了温度计,有利于控制反应温度
b.增加了分液漏斗,能随时补充反应混合液,减少反应物蒸发
c.增加了冷凝装置,有利于收集产物
d.反应容器容积大,容纳反应物的量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代硫酸的制法是隔绝空气锻烧绿矾(FeSO47H2O),将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,剩余的固体为红棕色。已知SO3的熔点是16.8°C,沸点是44.8°C,在加热条件下SO3具有比较强的氧化性。完成下列各空:
(1)绿矾油中溶质的化学式为_________。
(2)用下图装置煅烧绿矾并检验气体产物,煅烧一段时间后,发现D中U型管出现无色粘稠的液体,B中品红溶液褪色。

① 上述装置正确的连接顺序是A→(_______________________)(用大写字母表示)。
② 写出煅烧绿矾的化学方程式_________。
(3)绿矾在空气中部分被氧化为硫酸铁,现取3.66g绿巩样品溶于稀盐酸,加人足贵的BaCl2溶液,过滤得沉淀4.66g,向溶液中通入56mL(标准状况)氯气恰好将Fe2+完全氧化,计算变质后的绿矾晶体中n(Fe3+):n(Fe2+)为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是( )
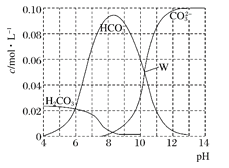
A. W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)<0.1mol·L-1
C. pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D. pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的叙述,正确的是
A. 离子化合物中一定含有离子键 ,可能含共价键
B. 单质分子均不存在化学键
C. 含有共价键的分子一定是共价化合物
D. 含有共价键的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案设计中,可行的是( )
A. 用萃取的方法分离汽油和煤油
B. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
C. 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D. 用加热、蒸发的方法可以除去食盐中的CaCl2、MgCl2等杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S )随温度(T )变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有 。
(2)加入BaCl2的目的是 ,加MgO后过滤所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式: ;
②产品中Mg(ClO3)2·6H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一支50 mL酸式滴定管中盛有溶液,液面恰好在10.00 mL刻度处,把滴定管中的溶液全部流下排出盛接在量筒中,量筒内溶液的体积是( )
A.大于40.00 mLB.40.00 mLC.大于10.00 mLD.10.00 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com