
VL Fe2(SO4)3溶液中含有Fe3+mg,则溶液中SO42﹣的物质的量浓度为()
A. 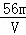 mol/L B.
mol/L B. 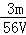 mol/L C.
mol/L C. 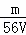 mol/L D.
mol/L D. 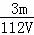 mol/L
mol/L
科目:高中化学 来源: 题型:
C、O、Si、Cl、Na、Fe是中学化学中常见的六种元素.
(1)Si位于元素周期表第三周期第ⅣA族,Fe2+的离子结构示意图 ,Cl的基态原子外围电子层排布式为 ;
(2)用“>”或“<”填空:
第一电离能 键能 沸点
O Na H﹣Cl H﹣Si CO2 H2O
(3)氯的一种常见含氧酸有漂白性,它与H2CO3酸性强弱不同,写出可以证明此结论一个化学方程式 ;
(4)黄绿色气体二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.工业上常利用氯酸钠和浓盐酸来制备ClO2,同时还得到一种黄绿色的气体单质、一种无色液体和一种常见离子化合物.写出该反应的化学方程式,并标出电子转移的方向和数目: ;
(5)Ti倍称为继铁铝之后“21世纪”金属,应用前景很广.钛铁矿(FeTiO3)可被一氯化碳还原为铁和TiO2固体.在25℃、101KPa下,已知煤消耗7克CO,吸收aKJ热量,该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事故的处理方法正确的是()
A. 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭
B. 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦
C. 皮肤上溅有较多的浓硫酸,赶紧用水冲洗
D. 衣服沾上大量的浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中
查看答案和解析>>
科目:高中化学 来源: 题型:
用某仪器量取液体,若仰视时读数为xmL,平视时读数为ymL,俯视时读数为zmL,若x>y>z,则所使用的仪器可能是()
A. 滴定管 B. 烧杯 C. 量筒 D. 容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
某物质A加热分解,产物都是气体,化学方程式为2A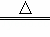 B+2C+2D.测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为()
B+2C+2D.测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为()
A. 7d B. 5d C. 2.5d D. 2d
查看答案和解析>>
科目:高中化学 来源: 题型:
在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol•L﹣1和1.5mol•L﹣1,现向该溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是()
A. 反应后溶液中Fe3+物质的量为0.8mol
B. 反应后产生13.44L H2(标准状况)
C. 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol
D. 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在中性条件下钢铁易发生吸氧腐蚀时,正极上发生的电极反应是()
A. 2H++2e﹣→H2 B. Fe2++3e→Fe
C. 2H2O+O2+4e﹣→4OH﹣ D. Fe3+﹣e→Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,化学反应2H2+O2═2H2O的能量变化如图所示,则反应的热化学方程式可表示为()

A. H2(g)+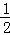 O2(g)═H2O(g)△H=(a+b) kJ•mol﹣1
O2(g)═H2O(g)△H=(a+b) kJ•mol﹣1
B. 2H2(g)+O2(g)═2H2O(g)△H=2(b﹣a) kJ•mol﹣1
C. H2(g)+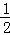 O2(g)═H2O(l)△H=(b+c﹣a) kJ•mol﹣1
O2(g)═H2O(l)△H=(b+c﹣a) kJ•mol﹣1
D. 2H2(g)+O2(g)═2H2O(l)△H=2(a﹣b﹣c) kJ•mol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com