
A.7.5 g B.5 g C.2.5 g D.0.5 g
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:阅读理解
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为__________________________________________。
(2)已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g) 的焓变ΔH=________kJ·mol-1。
(3)如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
①甲装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为_____________。
②乙装置中a极上的电极反应式为____________________________。
若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为________(用含w、a的表达式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省高三5月月考(理综)化学部分 题型:填空题
(15分)2009年12月7日~18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议。而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)
随时间变化如图所示:

①从反应开始到平衡,氢气的平均反应速 (H2)=_______。
(H2)=_______。
②下列措施中一定不能使 (CH3OH)/ (CO2)增大的是_______。
A.降低温度 B.缩小容器的容积
C.将水蒸气从体系中分离 D.使用更有效的催化剂
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5
mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的电离平衡常数K=________。(已知:10-5.6=2.5×10-6)。
HCO3-+H+的电离平衡常数K=________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为________;
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处的通入的是_____(填“乙醇”或“氧气”),b处电极上发生的电极反应是________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年吉林省高考复习质量监测(理综)化学部分 题型:填空题
(15分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)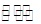 CH3OH(g)。
CH3OH(g)。
(1)下图是该反应在不同温度下CO的转化率随时间变化的曲线。
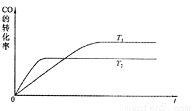
①该反应的焓变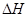 0(填“>”、“<”或“=”)。
0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1 K2(填“>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是 。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)已知在常温常压下
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)
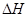 =-akJ·mol-1
=-akJ·mol-1
②2CO(g)+O2(g)=2CO2(g)
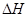 =-bkJ·mol-1
=-bkJ·mol-1
③H2O(g)=H2O(1)
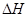 =-ckJ·mol-1
=-ckJ·mol-1
则,CH3(OH)(1)+O2(g)=CO(g)+2H2O(1)
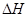 = kJ·mol-1
= kJ·mol-1
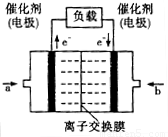
(3)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
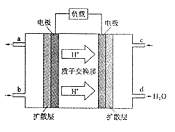
①该电池工作时,b口通入的物质为 ,c口通入的
物质为 。
②该电池正极的电极反应式为: 。
③工作一段时间后,当6.4g甲醇完全反应生成CO2时,
有 NA个电子转移。
(4)以上述电池做电源,用下图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
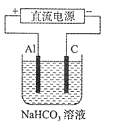
, 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com