

| A. | N为乙酸 | |
| B. | 过程①中可加入LiAlH4等还原剂将乙醇转化为N | |
| C. | 过程②如果加热一段时间后发现忘记加瓷片,应停止反应,待冷却后补加 | |
| D. | 可用饱和碳酸钠溶液除去乙酸乙酯中混有的N |
分析 由转化关系可知,①中CH3CH2OH被强氧化剂氧化生成N为CH3COOH,②为乙醇与乙酸的酯化反应生成乙酸乙酯,以此来解答.
解答 解:由转化关系可知,①中CH3CH2OH被强氧化剂氧化生成N为CH3COOH,②为乙醇与乙酸的酯化反应生成乙酸乙酯,
A.由上述分析可知,N为乙酸,故A正确;
B.过程①中可加入强氧化剂将乙醇转化为N,故B错误;
C.过程②如果加热一段时间后发现忘记加瓷片,应停止反应,待冷却后补加,否则易发生暴沸,故C正确;
D.饱和碳酸钠与乙酸反应,吸收乙醇、降低乙酸乙酯的溶解度,则可用饱和碳酸钠溶液除去乙酸乙酯中混有的N,故D正确;
故选B.
点评 本题考查有机物的推断,为高频考点,把握乙醇的性质、乙酸乙酯的制备为解答的关键,侧重分析与推断能力的考查,注意有机物的结构与性质应用,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
 图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )| X | Y | Z | |
| A | NaAlO2 | 盐 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | Al2O3 | 两性氧化物 | 氧化物 |
| D | 单质参与反应 | 置换反应 | 氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
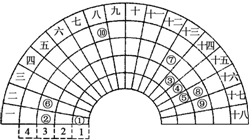 元素周期表的形式多种多样,下图是扇形元素周期表前四周期的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,下图是扇形元素周期表前四周期的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A. | ②、⑧、⑨对应原子半径依次增大 | |
| B. | ②、⑨的氢化物晶体类型相同 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①、③、④、⑤形成的某种化合物中既含有共价键又含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
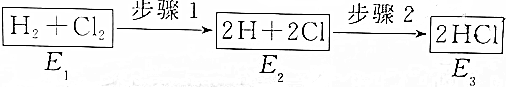
| A. | 步骤2是放热反应 | B. | 三个状态的能量E2最大 | ||
| C. | 要实现步骤1的转化,必须加热 | D. | 该反应放出的热量为E1一E3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 CH4、NH3、H2O和HF均为含10e-的分子.
CH4、NH3、H2O和HF均为含10e-的分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 13 | C. | 16 | D. | 19 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族的元素都是碱金属元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 原子序数为16的元素位于元素周期表的第3周期VIA族 | |
| D. | 第二周期ⅣA族元素的原子核电荷数和中子数一定为6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com