
【题目】己烷雌酚白色粉末是一种抗癌药物,难溶于水,易溶于乙醇,它的一种合成原理如下:


有关的实验步骤为(实验装置见图2):
①向装置A中依次加入沸石、一定比例的试剂X和金属钠。
②控制温度300 ℃,使反应充分进行。
③向冷却后的三颈烧瓶内加入HI溶液,调节pH至4~5。
④在装置B中用水蒸气蒸馏,除去未反应的试剂X。
⑤…
(1)装置A中冷凝管由________(填“a”或“b”)端通入冷凝水。
(2)步骤③中反应的化学方程式为__________________________________________________。
(3)装置B在进行水蒸气蒸馏之前,需进行的操作为____________,玻璃管的作用为________________。
(4)当观察到装置B的冷凝管中__________________,说明水蒸气蒸馏结束。
(5)进行步骤⑤时,有下列操作(每项操作只进行一次):
a.过滤;b.加入水进行反萃取;c.冷却、抽滤,用水洗涤晶体;d.向三颈烧瓶中加入乙醇,得己烷雌酚的乙醇溶液。正确的操作顺序是________(填字母)。
【答案】 a 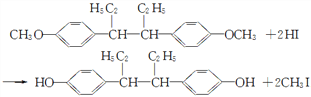 检验装置气密性 平衡气压,检查装置是否阻塞 液体变为无色透明 dbca
检验装置气密性 平衡气压,检查装置是否阻塞 液体变为无色透明 dbca
【解析】(1)根据采用逆流冷凝效果好可知,冷凝管由a通入冷凝水,故答案为:a;
(2)根据实验原理可知,![]() 在钠的作用下先生成
在钠的作用下先生成![]() ,
,![]() 在酸性条件下与HI反应生成
在酸性条件下与HI反应生成![]() ,所以步骤③中反应的化学方程式为
,所以步骤③中反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)在进行蒸馏之前,要检验装置气密性,根据装置图可知,玻璃管可以平衡气压,检查装置是否阻塞,故答案为:检验装置气密性;平衡气压,检查装置是否阻塞;
(4)X、碘甲烷难溶于水,所以当观察到装置B的冷凝管中 液体变为无色透明,说明水蒸气蒸馏结束,X已经除去,故答案为:液体变为无色透明;
(5)⑤实验主要目的是提纯己烷雌酚,用反应萃取的方法,先将己烷雌酚溶于乙醇,再用水除去乙醇,过滤可得最终产品,所以实验的顺序为dbca,故答案为:dbca。


科目:高中化学 来源: 题型:
【题目】写出下列有机物的系统命名或结构简式:
(1) _____________________________。
_____________________________。
(2)CH3CH(CH3)C(CH3)2CH2CH3_____________________。
(3)2,4,6-三甲基-5-乙基辛烷________________________________。
(4)3-甲基-1-戊炔____________________。
(5)![]() _____________________________。
_____________________________。
(6)2-甲基-2-丁烯__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了如下图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是

A. 它们的一氯代物均只有三种
B. 它们之间互为同系物
C. 三星烷与乙苯互为同分异构体
D. 六星烷的化学式为C18H24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol羟基与1 mol氢氧根离子所含的质子数和电子数均为9NA
B. 1 L 0.1 mol·L-1的NaHCO3溶液中HCO![]() 、CO
、CO![]() 的离子数之和为0.1NA
的离子数之和为0.1NA
C. 0.1 mol·L-1的CuCl2溶液中含有Cl-的数目为0.2NA
D. 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、A1,少量Cr、FeS等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为________________。
(2)“溶解”时放出的气体为_________(填化学式)。
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为______________。
(4)己知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为__________;过滤2所得滤渣的成分为___________(填化学式)。
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式______________。
(6)若加热不充分,则制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·y Ni(OH)2。现称取8.29g xNiOOH·y Ni(OH)2样品溶于稀硫酸,搅拌至溶液澄清,定容至200mL,从中移取20.00 mL,用0.010mol·L-1的KMnO4标准溶液滴定,重复上述操作2次,平均消耗KMnO4 标准溶液 20.00 mL。已知 5Ni2++MnO4-+8H+=5Ni3++Mn2++4H2O,则x=_________,y=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某双原子分子构成的气体,其摩尔质量为M g·mol-1,该气体的质量为m g,阿伏加德罗常数为NA mol-1,则:
①该气体在标准状况下的体积为________ L;
②该气体在标准状况下的密度为__________g·L-1;
③该气体所含的原子总数为_________个;
④该气体的一个分子的质量为_________g。
(2)设阿伏加德罗常数为NA。如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将 Na2Cr2O7溶液加到浓硫酸中,说明理由______________________。
(2)加入沸石的作用是_______。
(3)上述装置图中的D仪器的名称是_______。
(4)将正丁醛粗产品置于分液漏斗中分水时,水在 ______层(填“上”或“下”)。
(5)反应温度应保持在90—95℃,其原因是_______________。
(6)本实验中,正丁醛的产率为_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素(核电荷数小于20)最外层电子数是次外层电子数的a(1<a<4)倍,则该原子核内的质子数是( )
A. 2a B. 8a+2 C. 2a+10 D. 2a+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.原子最外层电子数比次外层电子数多的元素一定位于第二周期
B.从氟到碘,单质与氢气发生化合反应越来越难
C.14 C和14N两种核素的质量数相同,中子数也相同
D.离子化合物中可能含有共价键,但共价化合物中一定不含离子健
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com