
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为__________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为__________。平衡时A的转化率为__________,列式并计算反应的平衡常数K________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________ mol·L-1。
答案 (1)升高温度、降低压强
(2)(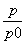 -1)×100% 94.1%
-1)×100% 94.1%
A(g) B(g) + C(g)
起始浓度
(mol·L-1) 0.10 0 0
平衡浓度
(mol·L-1)0.10×(1-94.1%) 0.10×94.1% 0.10×94.1%
K=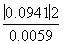 ≈1.5
≈1.5
(3)①0.10×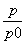 0.10×(2-
0.10×(2-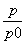 ) ②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
) ②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
解析 通过分析表格中数据,根据压强之比等于物质的量之比入手解决相关问题。
(1)要提高A的转化率,应通过改变条件使平衡正向移动,可以从浓度、温度、压强三个方面考虑,可从容器中分离出B、C或扩大容器的体积(降低压强)或升高温度。
(2)相同条件下,在密闭容器中气体的压强之比等于物质的量之比,设反应后气体的总物质的量为x,则有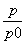 =
= ,故x=
,故x=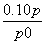 mol,而气体的物质的量的增加量等于消耗的A的物质的量,故A的转化率为
mol,而气体的物质的量的增加量等于消耗的A的物质的量,故A的转化率为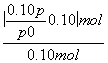 ×100%=(
×100%=(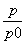 -1)×100%,将表中的数据代入公式中可得平衡时A的转化率为(
-1)×100%,将表中的数据代入公式中可得平衡时A的转化率为(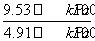 -1)×100%≈94.1%;根据化学方程式列出平衡三段式,注意三段式中使用的都是浓度,即可求得平衡常数。
-1)×100%≈94.1%;根据化学方程式列出平衡三段式,注意三段式中使用的都是浓度,即可求得平衡常数。
(3)结合(2)的解析可知n(A)=0.10 mol-(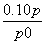 -0.10) mol=0.10×(2-
-0.10) mol=0.10×(2-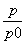 ) mol;根据表中的数据,可知a=0.10×(2-
) mol;根据表中的数据,可知a=0.10×(2-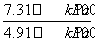 ) mol·L-1≈0.051 mol·L-1,通过表中的数据可知,在达到平衡前每间隔4 h,A的浓度减少约一半,故反应在12 h时,A的浓度为0.5×0.026 mol·L-1=0.013 mol·L-1。
) mol·L-1≈0.051 mol·L-1,通过表中的数据可知,在达到平衡前每间隔4 h,A的浓度减少约一半,故反应在12 h时,A的浓度为0.5×0.026 mol·L-1=0.013 mol·L-1。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.利用高纯硅可以制成光电池,将光能直接转化为电能
B.CO、CO2均易与血红蛋白结合而中毒
C.在SiO2制备高纯硅的过程中只涉及置换反应
D.SiO2和H2O反应可直接制备H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为( )
A.2∶1∶2 B.2∶1∶3
C.6∶3∶2 D.3∶7∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
A.体系的体积不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,某反应达平衡时平衡常数K=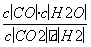 。恒容时,温度升高,H2的浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2的浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2的浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2OCO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g)CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g)1/2C(s)+1/2CO2(g)
ΔH3=-86.2 kJ·mol-1
(1)反应2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=____________(用ΔH1、ΔH2和ΔH3表示)。
(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线如图所示,结合各反应的ΔH,归纳lgKT曲线变化规律:
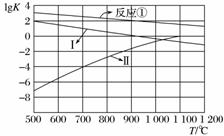
a)________________________________________________________________________;
b)________________________________________________________________________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900 ℃达到平衡,c平衡(CO)=8.0×10-5 mol·L-1,计算CO的转化率(忽略副反应,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入________。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为________________________;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)4NH3(g)+3O2(g) ΔH>0,如果反应的平衡常数K值变大,则下列说法错误的是( )
A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.改变的外界条件是升温
D.在平衡移动时逆反应速率先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
关于电离能的下列理解中错误的是( )
A.电离能可以表示原子或离子失去电子的难易程度
B.某原子的电离能越小,表示在气态时该原子越容易失去电子
C.第二电离能是气态+1价阳离子失去一个电子所需要的最小能量
D.电离能跟金属活动性顺序是对应的
查看答案和解析>>
科目:高中化学 来源: 题型:
下列观点错误的是( )
A.宏观物质都是由微观粒子构成的。微观粒子的种类和数量不同、彼此的结合方式多样,决定了物质的多样性
B.分子是保持物质化学性质的最小粒子,如果分子的组成或结构变了,其化学性质就变了
C.构成宏观物质的微观粒子之间存在多种形式的相互作用,如离子键、共价键等等
D.储存在物质中的化学能在化学反应前后是不变的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com