
| A. | 等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
分析 A.硫蒸气变化为硫固体为放热过程;
B.物质具有的能量越多越不稳定;
C.2g即1mol氢气燃烧放热285.8KJ,则2mol氢气燃烧放热为571.6kJ;
D.浓H2SO4与氢氧化钠反应放出的热量除了中和热之外还有浓硫酸溶于水放出的热量.
解答 解:A.硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,即前者放出热量多,故A错误;
B.由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知,金刚石具有的能量多,则石墨比金刚石稳定,故B错误;
C.在101 kPa时,2g即1mol氢气燃烧放热285.8KJ,则2mol氢气燃烧放热为571.6kJ,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol,故C错误;
D.在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,由于浓硫酸溶解放热,所以放出的热大于57.3 kJ,故D正确.
故选D.
点评 本题考查了物质稳定性与能量的关系、燃烧热和中和热的概念、热化学方程式的意义等知识,属于综合知识的考查,题目难度不大,注意把握中和热的概念以及反应热的计算方法,试题有利于培养学生的分析、理解能力及化学计算能力.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
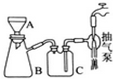 高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程:
高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程: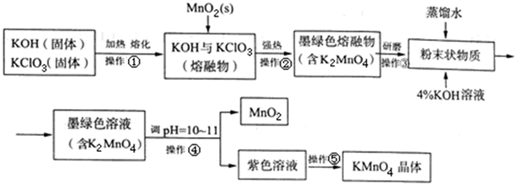
 (3)操作④、⑤要用到抽滤装置,仪器B的名称是抽滤瓶,相比普通的过滤,该装置的突出优点是过滤速度快、效果好.
(3)操作④、⑤要用到抽滤装置,仪器B的名称是抽滤瓶,相比普通的过滤,该装置的突出优点是过滤速度快、效果好.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol | B. | 1 mol | ||
| C. | >1 mol | D. | 0.6 mol<n(CO2)<1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤ | C. | ②⑤⑥ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古人利用明矾溶液的酸性来清洗青铜器上的铜锈 | |
| B. | 人体摄入适量的油脂有利于促进维生素的吸收 | |
| C. | 《肘后备急方》中记载“青蒿一握,以水二升渍,绞取汁”,所述过程不涉及化学变化 | |
| D. | 手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥⑧ | B. | ①④⑥⑧ | C. | ①④⑤⑥⑦ | D. | ②⑤⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com