
【题目】物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A.2:3 B. 1:5 C.1:4 D.2:5
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。
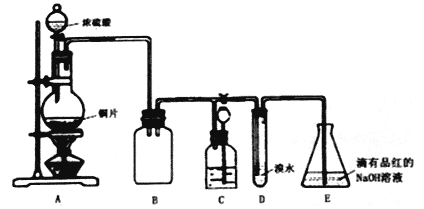
(1)装置A中发生反应的化学方程式是____________,装置B的作用是____________。
(2)设计装置D的目的是验证SO2的_____________性,E中NaOH全部转化为NaHSO3的标志是____________。
(3)装置C的作用是贮存多余的气体,C中应放置的液体是________。
(4)反应结束时烧瓶中Cu有剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到目的是________(填序号);
a.用酸碱中和滴定法测定 b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液pH值 d.与足量BaCl2溶液反应,称量生成沉淀的质量
(5)向E瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
② | 滴加少量棕红色的KI3溶液,振荡 | II | |
③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
④ | 加入几小块CaCO3固体 | 有气泡产生 |
(6)请设计简单实验证明室温下HSO3-的电离平衡常数Ka与水解平衡常教Kb的相对大小_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是短周期界素中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出Z在元素周期表中的位置为第 周期、第 族。
(2)气体分子YW2的电子式为 。
(3)由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为 。
(4)在一定条件下,由X单质与单质Z可化合生成E,工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式 。该反应中被氧化的E与参与反应的E的质量之比 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【无机工业流程】

实验室从含碘废液(除H2O外,含有CCl4、I2、I- 等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程为 ;该操作将I2还原为I- 的目的是 。
(2)操作X的名称为____________。

(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)已知:5SO![]() +2IO
+2IO![]() +2H+===I2+5SO
+2H+===I2+5SO![]() +H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO
+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO![]() 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO![]() 的实验方案:取适量含碘废水用CCl4多次萃取、分液直到水层用淀粉溶液检验不出有碘单质存在;____________________
的实验方案:取适量含碘废水用CCl4多次萃取、分液直到水层用淀粉溶液检验不出有碘单质存在;____________________
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
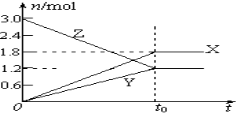
A.该反应的化学方程式为:3X+2Y![]() 2Z
2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺(NH2Cl)、二氯胺(NHCl2)和三氯胺(NCl3)。氯胺消毒时首先发生水解,生成具有强烈杀菌作用的次氯酸。
(1)NH2Cl中氯元素的化合价为___________,其电子式为__________。
(2)NH2Cl水解的离子方程式为____________。
(3)三氯胺在常温下为黄色黏稠的油状液体,有毒,在弱酸性溶液中稳定性较好。将0.01 mol NCl3通入100mL0.5mol/LNa2S03溶液中,转移电子的物质的量为___________。
(4)己知:2NH3(g)+3C12(g)=N2(g)+6HCl(g)△H1=-469kJ/mol
N2(g)+3C12(g)=2NC13(g) △H2=+520kJ/mol
NH3(g)+3C12(g)= NC13(g)+ 3HCl(g)△H3
则△H3=__________kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类的生活息息相关,下列有关说法正确的是( )
A.因铝表面能形成致密的氧化膜,所以铝制餐具可以长期使用
B.因废弃物易污染环境,腈纶不宜大量取代棉、麻等天然材料
C.SiO2用途广泛,因其高熔点的特性成为光导纤维的主要原料
D.有机玻璃(聚甲基丙烯酸甲酯)是通过缩聚反应制得的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~500 ℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com