
【题目】实验室用固体烧碱配制0.5mol/L的NaOH溶液490mL,用质量分数为98%,密度为1.84 g/cm3的浓硫酸配制0.6mol/L的硫酸溶液500mL。请回答下列问题:
(1)计算需要NaOH固体质量_________ g。
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒⑥托盘天平 ⑦量筒。配制以上两种溶液必须使用的玻璃仪器_________(填序号),还缺少的仪器是_________。
(3)定容的具体操作方法是:________
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用__________ mL量筒最好。
(5)配制过程中,下列操作会引起结果偏高的是__________(填序号)
①未洗涤烧杯、玻璃棒
②称量NaOH的时间太长
③定容时俯视刻度
④容量瓶不干燥,含有少量蒸馏水
⑤NaOH溶液未冷却至室温就转移到容量瓶
⑥量取浓硫酸时,仰视量筒刻度线
【答案】10.0 ①④⑤ 胶头滴管 将水沿玻璃棒注入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线 16.3 20 ③⑤⑥
【解析】
(1)依据配制溶液的体积选择合适的容量瓶,依据m=cVM计算需要溶质的质量;
(2)根据配制一定物质的量浓度的溶液步骤选用仪器,然后判断还缺少的仪器;
(3)根据定容的操作叙述;
(4)依据![]() 计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要用浓硫酸的体积,依据浓硫酸体积选择合适规格的量筒;
计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要用浓硫酸的体积,依据浓硫酸体积选择合适规格的量筒;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据![]() 进行误差分析。
进行误差分析。
(1)用固体烧碱配制0.5mol/L的NaOH溶液490mL,应选择500mL容量瓶,实际配制500mL溶液,需要氢氧化钠的质量:0.5mol/L×0.5L×40g/mol=10.0g,故答案为:10.0;
(2)配制一定物质的量浓度的溶液的实验步骤为:计算、称量(量取)、溶解(稀释)、冷却、转移、洗涤、定容、摇匀等,必须使用的玻璃仪器有:烧杯、500mL容量瓶、玻璃棒、胶头滴管等,故还缺少的玻璃仪器为胶头滴管,故答案为:①④⑤;胶头滴管;
(3)定容的具体操作方法是将水沿玻璃棒注入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线,故答案为:将水沿玻璃棒注入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线;
(4)98%、密度为1.84g/cm3的浓硫酸的物质的量浓度为![]() ,设需要浓硫酸的体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=0.6mol/L×0.5L,解得V=16.3mL,量取16.3mL溶液,应选择20mL量筒,故答案为:16.3;20;
,设需要浓硫酸的体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=0.6mol/L×0.5L,解得V=16.3mL,量取16.3mL溶液,应选择20mL量筒,故答案为:16.3;20;
(5)①未洗涤烧杯、玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低,故不选;
②称量NaOH的时间太长,导致秤取的固体中氢氧化钠质量偏小,溶质的物质的量偏小,溶液浓度偏低,故不选;
③定容时俯视刻度,导致溶液体积偏小,溶液浓度偏高,故选;
④容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
⑤NaOH溶液未冷却至室温就转移到容量瓶,冷却后,溶液体积偏小,溶液浓度偏高,故选;
⑥量取浓硫酸时,仰视量筒刻度线,导致量取浓硫酸体积偏大,溶质的物质的量偏大,溶液浓度偏高,故选;
故答案为:③⑤⑥。


科目:高中化学 来源: 题型:
【题目】⑴可逆反应FeO(s)+CO(g)Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T/K | 938 | 1100 |
K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量________;充入氦气,混合气体的密度________(填“增大”“减小”或“不变”)。
⑵常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________ (填编号)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②据上表数据,请你判断下列反应不能成立的是________(填编号)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN C.CO2+H2O+2NaClO=Na2CO3+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,氨水的电离平衡常数为Kb,用蒸馏水稀释1 mol·L-1氨水至0.01 mol·L-1,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A.c(OH-)
B.c(OH-)/c(NH3·H2O)
C.c(NH3·H2O)/c(NH4+)
D.Kb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)![]() xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)

A. P3>P4,y轴表示B的转化率 B. P3<P4,y轴表示B的体积分数
C. P3<P4,y轴表示混合气体的密度 D. P3>P4,y轴表示混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学以废旧铝制易拉罐为原料制备Al(OH)3其流程如图:
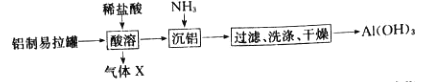
(1)“酸溶”时,增大盐酸的浓度反应速率将___(填“增大”或“减小”)。
(2)气体X是___(填“H2”或“CO2”)。
(3)一定条件下,将1molN2和3molH2置于lL密闭容器中合成NH3,10min后测得H2为l.2mol,则用H2表示该反应的速率为___molL-1min-1。
(4)氢氧化铝是___(从性质上分类)氢氧化物,它与盐酸反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
A.与NaOH反应的氯气为0.25 mol
B.n(Na+):n(Cl-) 可能为7:3
C.若反应中转移的电子为n mol,则0.15n0.25
D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),5 min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(L·min)。
xC(g)+2D(g),5 min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(L·min)。
(1)B的反应速率v(B)=___,x=___。
(2)A在5 min末的浓度是_______。
(3)此时容器内的压强与开始时之比为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2![]() 2CO2+ 4H2O。下列说法不正确的是
2CO2+ 4H2O。下列说法不正确的是
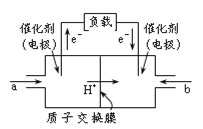
A.左电极为电池的负极,a处通入的物质是甲醇
B.正极反应式为:O2+ 2H2O + 4e-= 4OH-
C.负极反应式为:CH3OH + H2O-6e- = CO2+ 6H+
D.该电池提供1mole-,消耗氧气0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是

选项 | 试剂 | 现象 | 结论 |
A | 氯化铁溶液 | 溶液变色 | 含有羟基 |
B | 银氨溶液 | 有银镜产生 | 含有醛基 |
C | 碳酸氢钠溶液 | 有气泡产生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳双键 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com