
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
反应A(g)+2B(g)=C(g)的反应过程中能量变化如右下图所示。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是
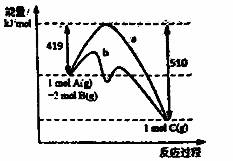
A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.催化剂降低了该反应的活化能
D.该反应的焓变△H=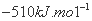
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2—离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2。
请回答下列问题:
⑴A、B、C、D四种元素中,电负性最大的是 (填元素符号)。
⑵B的氢化物的沸点远高于A的氢化物的主要原因是 。
 ⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 。
⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 。
⑷E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有 。
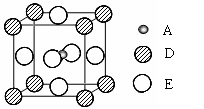
⑸最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为 ;该晶体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g) ΔH<0。
zC(g) ΔH<0。
达到化学平衡后测得A的浓度为0.20 mol·L-1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.35 mol·L-1。则下列有关判断正确的是
A.平衡向逆反应方向移动了 B. x+y>z
C.B的转化率下降 D.C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(1)Zn(s) + 1/2O2(g) = ZnO(s) △H=-348.3 kJ/mol
(2)2Ag(s) + 1/2O2(g) = Ag2O(s) △H=-31.0 kJ/mol
则 Zn(s) + Ag2O(s) = ZnO(s) + 2Ag(s) 的△H等于( )
A.+317.3 kJ/mol B.-379.3 kJ/mol
C.-332.8kJ/mol D.-317.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ:反应产物的定性探究。
实验装置如图所示:(固定装置已略去)
(1)A中反应的化学方程式为 。
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ:反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
| 硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
资料2:X-射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是 __。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol/L
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol/L Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为 _。(已知:2Cu2++4I-===2CuI+I2,2S2O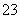 +I2===S4O
+I2===S4O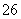 +2I-)
+2I-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com