
【题目】现有2.8 g Fe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A. 反应后溶液中铁元素可能以Fe2+形式存在
B. 反应后的溶液最多还能溶解1.4 g Fe
C. 反应后溶液中c(NO3)=0.85 mol·L1
D. 1.12 L气体可能是NO、NO2的混合气体
【答案】C
【解析】
Fe和硝酸反应生成硝酸盐和氮氧化物,氮氧化物在标况下体积是1.12L,则n(NOx)=![]() =0.05mol,反应后溶液pH=1说明溶液呈酸性,硝酸有剩余,则Fe完全反应生成Fe(NO3)3。A.反应后硝酸有剩余,则Fe完全反应生成Fe(NO3)3,没有硝酸亚铁生成,故A错误;B.反应后溶液还能溶解Fe,当Fe完全转化为Fe(NO3)2,消耗的Fe质量最多,反应后剩余n(HNO3)=0.1mol/L×0.2L=0.02mol,根据3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O知,硝酸溶解的n(Fe)=
=0.05mol,反应后溶液pH=1说明溶液呈酸性,硝酸有剩余,则Fe完全反应生成Fe(NO3)3。A.反应后硝酸有剩余,则Fe完全反应生成Fe(NO3)3,没有硝酸亚铁生成,故A错误;B.反应后溶液还能溶解Fe,当Fe完全转化为Fe(NO3)2,消耗的Fe质量最多,反应后剩余n(HNO3)=0.1mol/L×0.2L=0.02mol,根据3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O知,硝酸溶解的n(Fe)=![]() ×3=0.0075mol,根据转移电子相等知,硝酸铁溶解的n(Fe)=
×3=0.0075mol,根据转移电子相等知,硝酸铁溶解的n(Fe)=![]() ×
×![]() =0.025mol,则最多还能溶解m(Fe)=(0.0075+0.025)mol×56g/mol=1.82g,故B错误;C.根据N原子守恒知,反应后溶液中n(NO3-)=n(HNO3)+3n[Fe(NO3)3]=0.02mol+3×
=0.025mol,则最多还能溶解m(Fe)=(0.0075+0.025)mol×56g/mol=1.82g,故B错误;C.根据N原子守恒知,反应后溶液中n(NO3-)=n(HNO3)+3n[Fe(NO3)3]=0.02mol+3×![]() =0.17mol,则c(NO3-)=
=0.17mol,则c(NO3-)=![]() =0.85mol/L,故C正确;D.2.8gFe完全转化为Fe(NO3)3时转移电子物质的量=
=0.85mol/L,故C正确;D.2.8gFe完全转化为Fe(NO3)3时转移电子物质的量=![]() ×3=0.15mol,假设气体完全是NO,转移电子物质的量=0.05mol×(5-2)=0.15mol,假设气体完全是NO2,转移电子物质的量=0.05mol×(5-4)=0.05mol<0.15mol,根据转移电子相等知,气体成分是NO,故D错误;故选C。
×3=0.15mol,假设气体完全是NO,转移电子物质的量=0.05mol×(5-2)=0.15mol,假设气体完全是NO2,转移电子物质的量=0.05mol×(5-4)=0.05mol<0.15mol,根据转移电子相等知,气体成分是NO,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A. 该硫酸试剂的物质的量浓度为18.4
B. 该硫酸与等体积的水混合所得溶液的质量分数小于49%
C. 配制50.0mL 4.6mol·L-1的稀硫酸需取该硫酸12.5mL
D. 2.4gMg与足量的该硫酸反应得到H2 的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:__________________;
(2)实验中需加热至恒重的目的是:_________________________;
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_________________;
(2)实验中判断沉淀是否完全的方法是_______________________________。
方案三:按如图装置进行实验:

(1)B装置内所盛试剂是__________ 分液漏斗中____________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为____________________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是25℃时几种难溶电解质的溶度极数值:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp | 1.0×10-12 | 1.0×10-20 | 1.0×10-16 | 1.0×10-38 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为___________(填名称)而除去。
(2)①中加入的试剂应选择________为宜,其原因是_______________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式__________________________________。
(4) 向浓度均为0.1mol/L-1的Fe(NO3)3和Cu(NO3)2混合溶液中,逐滴加入NaOH.下列示意图表示生成沉淀的总物质的量与加入NaOH的体积的关系,合理的是(____)
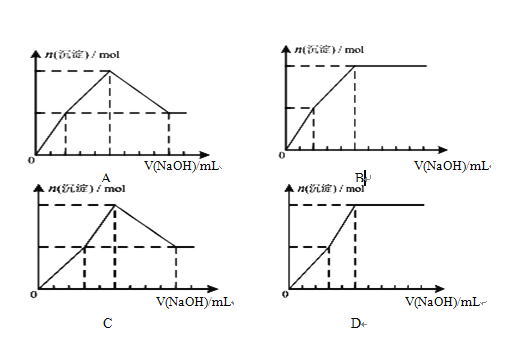
(5)若将某MgCl2、FeCl3均为0.1 mol·L-1混合溶液中的pH用MgO调整至pH=4,则溶液中![]() 比值约为______________________。
比值约为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2009年4月在很多国家爆发了甲型H1N1流感,造成多人死亡。一种叫达菲的药物在治疗各种流感中得到广泛使用,达菲的结构简式如右图,下列说法中正确的是

A. 达菲的分子式为C12H20O8
B. 1mol达菲与足量的NaOH溶液反应,消耗NaOH 1mol
C. 1mol达菲与氢气在一定条件下发生反应,最多消耗氢气3mol
D. 达菲能发生水解反应生成小分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题
(1)硬脂酸的分子式____________
(2)CO +3H2![]() CH4 + H2O,其中有机产物的原子利用率为_______(保留两位有效数字)
CH4 + H2O,其中有机产物的原子利用率为_______(保留两位有效数字)
(3)制备酚醛树脂的化学方程式______________________________________________________
(4)乙烯与丙烯等物质的量发生加聚反应的化学方程式__________________________________
(5)甘氨酸的结构简式__________________________
(6)H2C(OH)CH2CHO的系统命名法为_______________________________
(7)葡萄糖(写结构简式)酿酒的化学方程式_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 向新制氯水中加入少量CaCO3粉末后,溶液的pH减小
B. SO2、乙烯都能使溴水褪色,但原理不同
C. NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应
D. FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用以下装置制备氮化镁并探究氮化镁的某些性质。
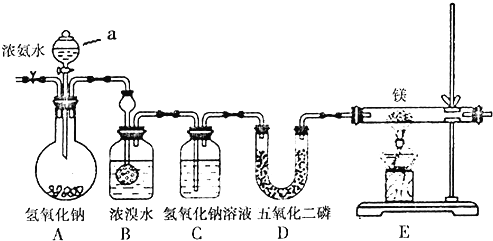
已知:氮化镁易跟水发生反应;装置B中发生的主要反应为:3Br2+2NH3=6HBr+N2、HBr+NH3=NH4Br。
实验步骤及现象:
①连接仪器并检查装置的气密性。
②通入惰性气体。
③打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡。
④点燃酒精灯,观察E中固体变成了黄绿色。
回答下列问题:
(1)A装置中仪器a的名称为______,通入惰性气体的目的是__________________。
(2)装置C的作用是______________________。
(3)D装置中的P2O5是一种非氧化性的酸性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______。
a.NH3 b. HI c. SO2 d. CO2
(4)E装置中发生反应的化学方程式为:___________________________。
(5)此装置中存在着明显缺陷,你的改进措施是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com