
高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+ CO(g)  2/3Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
2/3Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=__________,△H______0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=____________、CO的平衡转化率=____________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
科目:高中化学 来源:2016届辽宁省高三上学期第一次月考化学试卷(解析版) 题型:选择题
某溶液中含有NH4+、SO32-、SiO32-、Br- CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是
①反应前后,溶液中离子浓度基本保持不变的有四种 ②有胶状物质生成
③有刺激性气味气体产生④溶液颜色发生变化⑤溶液中至少发生了3个氧化还原反应
A.①②③④ B.①②③④⑤
C.①③④⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上学期期中测试化学试卷(解析版) 题型:选择题
单质X和Y相互反应生成化合物X2+Y2-,有下列叙述:
①X被氧化 ②X是氧化剂 ③X具有氧化性 ④XY既是氧化产物也是还原产物 ⑤XY中的Y2-具有还原性 ⑥XY中的X2+具有氧化性 ⑦Y的氧化性比XY中的X2+氧化性强。
以上叙述正确的是
A.①④⑤⑥⑦ B.①③④⑤
C.②④⑤ D.①②⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上学期期中测试化学试卷(解析版) 题型:选择题
用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
A.3∶2∶2 B.1∶2∶3
C.1∶3∶3 D.3∶1∶1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列溶液中Cl-的物质的量浓度最大的是
A.200mL 2mol/L MgCl2溶液
B.1000mL 2.5mol/L NaCl溶液
C.250mL 1mol/L AlCl3溶液
D.300mL 5mol/L KClO3溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期中理科化学试卷(解析版) 题型:选择题
下列说法正确的是
A.c(H+)=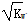 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变
D.向0.1mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期中理科化学试卷(解析版) 题型:选择题
在一个体积为1 L的密闭容器中,充入2 mol A和1 mol B,发生如下反应:2A(g) + B(g) xC(g),平衡后,C的体积分数为w%,若维持容器容积和温度不变,0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(
xC(g),平衡后,C的体积分数为w%,若维持容器容积和温度不变,0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(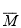 )和正反应速率[v(正)],随压强(P)的变化,一定符合的是
)和正反应速率[v(正)],随压强(P)的变化,一定符合的是
A. B.
B.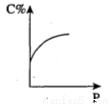
C.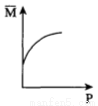 D.
D.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期中文科化学试卷(解析版) 题型:选择题
实验室保存下列药品的方法不正确的是
A.氢氧化钠保存在带玻璃塞的试剂瓶中 B.浓硝酸保存在棕色试剂瓶中
C.少量金属钠保存在煤油中 D.氢氟酸保存在密封的塑料瓶中
查看答案和解析>>
科目:高中化学 来源:2016届福建省莆田市高三上学期期中测试化学试卷(解析版) 题型:实验题
实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
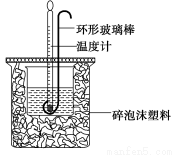
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是____________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1__________ΔH(填“<”、“>”或“=”),理由是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com