
 根据如图表示的一些物质或概念间的从属关系,下列各项中不正确的是:
根据如图表示的一些物质或概念间的从属关系,下列各项中不正确的是:| X | Y | Z | |
| A | 水泥 | 硅酸盐产品 | 无机非金属材料 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 吸氧腐蚀 | 电化学腐蚀 | 金属腐蚀 |


科目:高中化学 来源: 题型:
 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(kJ?mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
| 3 |
| ||
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是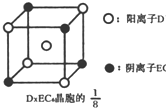
| 元素 | Mn | Fe | |
| 电离 能/kJ?mol-1 |
Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为___________________ _________。
(2)C的氢化物分子是 (填“极性”或“非极性”)分子。
(3)化合物BD3的分子空间构型是 。
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非
极性溶剂。据此可判断E(CO)5的晶体类型为 ;E(CO)5在一定条件下发生分解反应:E (CO)5 == E (s) +5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是 。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。
则: 体心立方晶胞和面心立方晶胞的棱长之比为: 。(保留比例式,不要求计算结果)
查看答案和解析>>
科目:高中化学 来源:2012届吉林省高二下学期期中考试化学试卷 题型:填空题
(12分)已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为___________________ _________。
(2)C的氢化物分子是 (填“极性”或“非极性”)分子。
(3)化合物BD3的分子空间构型是 。
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非
极性溶剂。据此可判断E(CO)5的晶体类型为 ;E(CO)5在一定条件下发生分解反应:E (CO)5 == E (s) + 5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是 。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。

则: 体心立方晶胞和面心立方晶胞的棱长之比为: 。(保留比例式,不要求计算结果)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com