
| A. | 甲苯和丙三醇 | B. | 乙醇和丙烯 | C. | 甲烷和乙烯 | D. | 苯和丁炔 |
分析 有机物的总质量一定,完全燃烧,产生的水的质量一定,由H原子守恒可知,有机物中H元素的质量分数相同,以此来解答.
解答 解:题目要求只需两物质的氢的质量百分数H%相同即可,
A.甲苯(C7H8)和丙三醇(C3H8O3)中H%均为$\frac{8}{92}$,符合题意,故A选;
B.乙醇(C2H6O)和丙烯(C3H6)中H元素的质量分数不同,故B不选;
C.甲烷(CH4)和乙烯(C2H4)中H元素的质量分数不同,故C不选;
D.苯(C6H6)和丁炔(C4H6)中H元素的质量分数不同,故D不选;
故选A.
点评 本题考查有机物燃烧反应的计算,为高频考点,把握H原子守恒及H元素的质量分数相同为解答的关键,侧重分析与计算能力的考查,注意有机物的分子式,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中充入1 mol N2和3 mol H2,充分反应后生成NH3的分子数目为2NA | |
| B. | 标准状况下,44.8 L氮气所含的共用电子对数目为2NA | |
| C. | 常温常压下,1 mol NaHSO4固体中含有的离子数目为2NA | |
| D. | 1 mol Fe与71 g Cl2充分反应后转移的电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
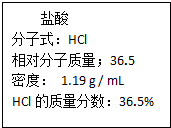 (I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.
(I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.| 物质类别 | 含氧强酸 | 碱 | 钠盐 |
| 化学式 | ①H2SO4②HClO4 | ③ ④Mg(OH)2 ④Mg(OH)2 | ⑤NaCl ⑥Na2SO3 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
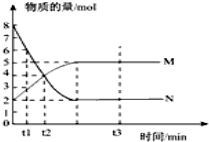 一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图示.
一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
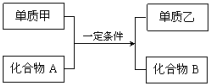 置换反应的通式可表示为:
置换反应的通式可表示为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.4mol/(L•s) | B. | v(C)=30mol/(L•min) | C. | v(B)=0.4mol/(L•min) | D. | v(A)=0.15mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com