B
分析:A.根据α-氨基乙酸的结构判断;
B.pH=13时,c(OH
-)=0.1mol/L,根据n=cV=
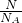
计算;
C.根据n=

=
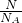
结合分子构成判断;
D.根据Na
2O
2的结构结合性质判断.
解答:A.α-氨基乙酸的结构简式为CH
2NH
2COOH,含有的共价键有2个C-H键,2个N-H键,1个C-N键,1个C-C键,1个C=O键,1个C-O键和1个O-H键,所以1molα-氨基乙酸(甘氨酸)分子中存在10N
A对共用电子,故A正确;
B.pH=13时,c(OH
-)=0.1mol/L,c(Ba
2+)=0.05mol/L,lLpH=13的Ba(OH)
2溶液中含有Ba
2+的数目为0.05N
A,故B错误;
C.NO
2和N
2O
4混合气体中N和O原子个数都为1:2,可按NO
2计算,n(NO
2)=1mol,则混合气体中原子数目为3N
A,故C正确;
D.1molNa
2O
2含有1molO-O键,为非极性键,则含有非极性键的数目为N
A的Na
2O
2为1mol,与水反应生成0.5molO,标准状况下体积为11.2L,故D正确.
故选B.
点评:本题考查阿伏加德罗常数,题目难度中等,本题注意物质的结构和性质,解答本题时注意把握相关计算公式的运用.易错点为A,注意有机物的结构式.

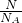 计算;
计算; =
=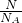 结合分子构成判断;
结合分子构成判断;

 阅读快车系列答案
阅读快车系列答案