
| A. | 2mol SO2和1mol O2在一定条件下充分反应后,所得混合气体的分子数小于2NA | |
| B. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA |
分析 A、二氧化硫和氧气的反应为可逆反应;
B、由1mol CH3COONa和少量CH3COOH形成的中性溶液中,c(H+)=c(OH-),根据溶液的电荷守恒来分析;
C、氮气和CO的摩尔质量均为28g/mol,且为双原子分子;
D、求出二氧化氮的物质的量,然后根据3mol二氧化氮和水反应转移2mol电子来分析.
解答 解:A、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故所得混合物中分子个数小于2NA个,故A错误;
B、由1mol CH3COONa和少量CH3COOH形成的中性溶液中,n(H+)=n(OH-),而根据溶液的电荷守恒可知:n(H+)+n(Na+)=n(OH-)+n(CH3COO-),故有:n(Na+)=n(CH3COO-)=1mol,个数为NA个,故B正确;
C、氮气和CO的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,且两者为双原子分子,故0.5mol混合物中含NA个原子,故C正确;
D、标况下6.72L二氧化氮的物质的量为0.3mol,而3mol二氧化氮和水反应转移2mol电子,故0.3mol二氧化氮转移0.2NA个电子,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入适量的水 | B. | 适当升高温度 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入等体积的浓度较大的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 已 知 | 类 推 | |
| A | 将铁粉投入稀硫酸中 Fe+H2SO4(稀)=FeSO4+H2↑ | 将铁粉投入稀硝酸中 Fe+2HNO3(稀)=Fe(NO3)2+H2↑ |
| B | 铝热法炼铁 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | 铝热法炼镁 2Al+3MgO$\frac{\underline{\;高温\;}}{\;}$3Mg+Al2O3 |
| C | 将乙烯通入溴水中 CH2=CH2+Br2→CH2BrCH2Br | 将丙烯通入溴水中 CH3CH=CH2+Br2→CH3CHBrCH2Br |
| D | 乙烯在适当条件下制聚乙烯 nCH2=CH2 $→_{加热、加压}^{催化剂}$ 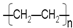 | 丙烯在适当条件下制聚丙烯 nCH3CH=CH2 $→_{加热、加压}^{催化剂}$  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯分子中的所有原子可能共平面 | |
| B. | CH2═CH-C6H5分子中的所有原子可能共平面 | |
| C. | 乙烷分子中的所有原子可能共平面 | |
| D. | 二氯甲烷分子为正四面体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用双氧水代替高锰酸钾制氧气 | |
| B. | 用多量的氯气进行性质实验 | |
| C. | 用溴水代替碘水进行萃取实验 | |
| D. | 用铜粉代替铜丝进行铜和浓硝酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
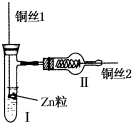 如图为氢气还原氧化铜的微型快速实验装置.实验前先将铜丝1处理成下端弯曲的小圆环,并用铁锤击成带小孔的小匙,将铜丝2一端弯曲成螺旋状.试回答下列问题:
如图为氢气还原氧化铜的微型快速实验装置.实验前先将铜丝1处理成下端弯曲的小圆环,并用铁锤击成带小孔的小匙,将铜丝2一端弯曲成螺旋状.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、W、R五种元素位于元素周期表前四周期,它们的原子序数依次增大
X、Y、Z、W、R五种元素位于元素周期表前四周期,它们的原子序数依次增大| 元素 | 相关信息 |
| X | 原子核外的价电子排布式为nsnnp2n |
| Y | 元素周期表中电负性最强的元素 |
| Z | Z与W位于同周期,且最外层有两个未成对电子 |
| w | 单质为淡黄色固体,能在火山口发现 |
| R | 原子的基态未成对电子致是同周期最多的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com