
| A. | 铁钉在空气中出现红色的铁锈,其负极反应式为:Fe-3e-═Fe3+ | |
| B. | 氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+NH4+═Mg2++NH3•H2O | |
| C. | 漂白粉溶液中加氯化亚铁溶液产生大量沉淀:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO | |
| D. | 向足量铝粉与稀盐酸反应后的溶液中滴加碳酸氢钠溶液:3HCO3-+Al3+═Al(OH)3↓+3CO2↑ |
分析 A.原电池中负极铁失去电子生成亚铁离子;
B.离子方程式两边正电荷不相等,违反了电荷守恒;
C.次氯酸具有强氧化性,能够将氢氧化亚铁氧化成氢氧化铁;
D.铝离子与碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体.
解答 解:A.铁钉在空气中出现红色的铁锈,其负极铁失去电子生成亚铁离子,正确的电极应式为:Fe-2e-═Fe2+,故A错误;
B.氢氧化镁白色沉淀溶于氯化铵溶液,反应生成氯化镁、一水合氨,正确的离子方程式为:Mg(OH)2+2NH4+═Mg2++2NH3•H2O,故B错误;
C.漂白粉溶液中加氯化亚铁溶液,亚铁离子被氧化成铁离子,正确的离子方程式为:2Fe2++5ClO-+5H2O═2Fe(OH)3↓+4HClO+Cl-,故C错误;
D.足量铝粉与稀盐酸反应后的溶液中的溶质为氯化铝,氯化铝溶液中滴加碳酸氢钠溶液,二者发生双水解反应,反应的离子方程式为:3HCO3-+Al3+═Al(OH)3↓+3CO2↑,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 足量二氧化碳通入NaOH溶液:CO2+OH-═HCO3- | |
| D. | 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
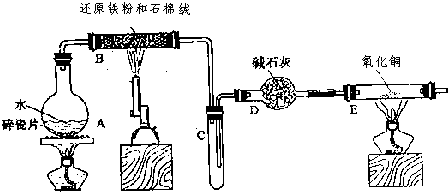
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理氯气实验中的尾气:OH-+Cl2═ClO-+Cl-+H2O | |
| B. | 硫酸铜与氢氧化钡溶液混合产生沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 用石灰石与稀盐酸制备二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 铜片放入浓硝酸中产生气体:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com