
| A. | 控制高能耗企业上马 | |
| B. | 倡导“绿色化学”理念,逐步实现化工企业零排放 | |
| C. | 加大对污染企业的整治力度 | |
| D. | 无节制地开采煤、石油、天然气等矿物资源 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 200mL 2 mol/LMgCl2溶液 | B. | 1000mL 2.5 mol/L NaCl溶液 | ||
| C. | 300mL 5 mol/L KCl溶液 | D. | 250mL 1 mol/L FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
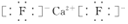 ;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O.
;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2912 kJ | B. | 3236 kJ | C. | 2953 kJ | D. | 3867 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com