
分析 根据Cl-+Ag+═AgCl↓计算XCl2的物质的量,再根据M=$\frac{m}{n}$计算其摩尔质量,进而计算X的相对分子质量,原子的质量数为原子的近似相对原子质量,根据质子数=质量数-中子数来计算X原子的质子数,利用质子数确定元素在周期表中的位置.
解答 解:(1)由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×1mol/L=0.02mol,
n(XCl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.02mol=0.01mol,
则M(XCl2)=$\frac{1.1g}{0.01mol}$=111g/mol,
所以XCl2相对分子质量为111,
所以X的相对原子质量=111-35.5×2=40,即X的质量数为40,
质子数=质量数-中子数=40-20=20,
故答案为:20;
(2)X为Ca,位于第四周期第ⅡA族,故答案为:第四周期第ⅡA族.
点评 本题考查反应方程式的计算、结构与位置关系等,难度不大,注重对基础知识的理解掌握.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数:C>D>A>B | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:Cn->D(n+1)->An+>B(n+1)+ | D. | 单质还原性:B>A>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.00mol NaCl中含有NA个NaCl分子 | |
| B. | 1.00mol NaCl中,所有Na+的最外层电子总数为8NA | |
| C. | 欲配制1.00L,1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 标准状况下,11.2LCH3CH2OH中含有分子的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氰分子中四原子共直线 | |
| B. | 氰分子中C≡N键长大于C≡C键长 | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰化氢在一定条件下能与烯烃发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
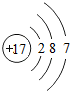 ;
; ,该化合物的水溶液在空气中久置后变质,生成一种单质和一种强碱,用化学方程式表示这一变化过程并用单线桥标记电子转移的方向和数目:
,该化合物的水溶液在空气中久置后变质,生成一种单质和一种强碱,用化学方程式表示这一变化过程并用单线桥标记电子转移的方向和数目: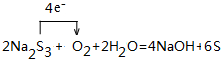
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3+HNO3;Na2CO3+HCl | B. | Cu(OH)2+HCl;Cu(OH)2+CH3COOH | ||
| C. | NaOH+H2SO4;KOH+NaHSO4 | D. | Na2CO3+HCl(少量);Na2CO3(少量)+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3(12e-) | B. | NOx(12e-) | C. | NH3(12xe-) | D. | NOx(12xe-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | ||
| ① | 430 | 1 | 1 | 0.95 | 0.95 |
| ② | 830 | 1 | 1 | 0.5 | 0.5 |
| ③ | 830 | 1.5 | 1 | ||
| A. | 正反应的△H>0 | B. | CO转化率③>② | ||
| C. | 实验①达到平衡的时间比②短 | D. | 430℃时,该反应的平衡常数为361 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com